(1)用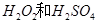 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: ====
==== △H=+64kJ/mol
△H=+64kJ/mol
 ====
====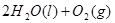 △H= -196kJ/mol
△H= -196kJ/mol
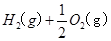 ="==="
="==="  △H= -286kJ/mol
△H= -286kJ/mol
在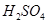 溶液中
溶液中 与
与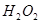 反应生成
反应生成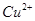 和
和 的热化学方程式为 。
的热化学方程式为 。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅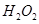 和3.0 mol/L的
和3.0 mol/L的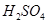 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| |
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| |
铜平均溶解速率 |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
| |
(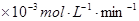 ) ) |
|
|
|
|
|
|
|
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(3)在提纯后的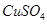 溶液中加入一定量的
溶液中加入一定量的 和
和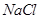 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是 。
的离子方程式是 。
(共8分)用下列:①H2O②H2O2③Ba(OH)2④Na2O2⑤Cl2⑥Ar⑦CO2等物质填空。 (1—4小题填序号)
(1) 由离子键和非极性键构成的是
(2) 由极性键和非极性键构成的是
(3) 不存在化学键的是
(4) 共价化合物有
(5) 写出下列物质的电子式:Na2O2
下列反应属于放热反应的是属于吸热反应的是(填字母)
| A.铝片与稀H2SO4反应制取H2 | B.碳酸钙高温分解成氧化钙和二氧化碳 |
| C.葡萄糖在人体内氧化分解 | D.氢氧化钾和硫酸中和 |
E.Ba(OH)2·8H2O与NH4Cl反应
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象是__________________________
(2)产生上述现象的原因是_______________;
(3)写出有关的离子方程式:_______________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
在一块大理石(主要成分是CaCO3)上,先后滴加1mol/LHCl溶液和0.1mol/LHCl溶液反应快的是_________________,先后滴加同浓度的热盐酸和冷盐酸,反应快的是____,用大理石块和大理石粉分别跟同浓度的盐酸起反应,反应快的是。
(1)(4分)某化学反应,设反应物总能量为E1,生成物总能量为E2。若E1>E2,则该反应为______热反应,该反应的能量转化是_________________________。
(2)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应是___________________,负极的电极反应是_______________________,原电池的总反应是____________________。