在元素周期表中,第3、4、5、6周期所含元素的数目分别是
| A.8、18、32、32 | B.8、18、18、32 | C.8、18、18、18 | D.8、8、18、18 |
设NA为阿伏加德罗常数的数值,下列说法正确的是()。
| A.常温常压下,8 g O2含有4NA个电子 |
| B.1 L 0.1 mol·L-1的氨水中有0.1NA个NH4+ |
| C.标准状况下,22.4 L盐酸含有NA个HCl分子 |
| D.1 mol Na被完全氧化生成Na2O2,失去2NA个电子 |
关于下列各装置图的叙述中,不正确的是 ( )。
| A.装置①可验证HCl气体在水中的溶解性 |
| B.装置②可用于收集H2、NH3、Cl2、HCl、NO2、NO等 |
| C.装置③中X为四氯化碳,可用于吸收氨气或氯化氢 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
按图装置通入X气体,并在管P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是 ( )。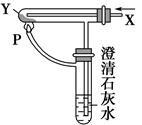
| A.H2和Fe2O3 |
| B.CO和CuO |
| C.H2和Na2CO3 |
| D.CO和Na2CO3 |
用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是 ( )。
| 选项 |
气体 |
a |
b |
c |
d |
| A |
SO2 |
浓硫酸 |
Cu |
H2O |
浓硫酸 |
| B |
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓硫酸 |
| C |
NH3 |
饱和NH4Cl溶液 |
消石灰 |
空集气瓶 |
固体NaOH |
| D |
NO |
稀硝酸 |
铜屑 |
H2O |
浓硫酸 |
下列有关实验原理或实验操作的叙述正确的是 ( )。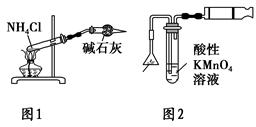
| A.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上称量 |
| B.欲除去NO中少量的NO2,将混合气体通入足量NaOH溶液 |
| C.实验室用图1所示装置制取少量氨气 |
| D.实验室用图2所示装置检验火柴头燃烧产生的SO2 |