银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
| A.锌为正极,Ag2O为负极; | B.锌为阳极,Ag2O为阴极; |
| C.原电池工作时,负极区pH减小; | D.原电池工作时,负极区pH增大; |
化学与社会、环境等密切相关,下列有关说法中不正确的是
| A.利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 |
| B.单质硅是将太阳能转化为电能的常用材料 |
| C.PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 |
| D.“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。利用CO2合成聚碳酸酯类可降低塑料的做法符合“低碳经济”的要求 |
下列措施有利于节能减排、改善环境质量的是
①研制开发新型燃料电池汽车,减少机动车尾气污染
②开发推广太阳能、水能、风能等能源
③使用填埋法处理未经分类的生活垃圾
④推广使用燃煤脱硫技术,防治SO2污染
| A.①②④ | B.①② | C.①②③④ | D.③④ |
化学在日常生活中有着重要的应用,下列说法中正确的是
| A.地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油。 |
| B.棉、麻、丝、毛及合成纤维完全燃烧都只生成C02和H20,对环境不会有影响 |
| C.BaSO4在医学上用作钡餐,Ba2+对人体无毒 |
| D.“落汤螃蟹着红袍”肯定发生了化学变化 |
下列叙述正确的是
| A.红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,加少量的水形成绿色溶液 |
| B.检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 |
| C.在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水可检验淀粉是否已发生水解和是否完全水解 |
| D.铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
下列说法不正确的是
| A.乙烯、乙醇均能使酸性高锰酸钾溶液褪色 |
| B.通过乙烷的取代反应或乙烯的加成反应都可以制取纯净的氯乙烷 |
| C.淀粉、纤维素都属于糖类,它们通式相同,但它们不互为同分异构体 |
D.1mol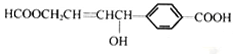 可与2molNaOH反应 可与2molNaOH反应 |