已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应
① A + H2O → B + C ② C + F → D ③ D + NaOH 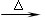 F + E + H2O
F + E + H2O
(1)写出它们的化学式:A 、B 、 D 、
E 、F ;
(2)写出各步反应的离子方程式,并指反应①的氧化剂和还原剂物质的量比。
① 、氧化剂与还原剂物质的量比为: 。
② 。
③ 。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式 。
(4分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
把氯气通入紫色石蕊溶液中,可以观察到的现象是:;
请你解释其中的原因
等物质的量的CO和CO2中所含O原子个数之比,二者的质量之比,在同温同压下的体积之比。
一块金属钠露置在空气中,发生:银白色→变暗→变白→出现液滴→白色固体一系列的变化,请分别写出如下方程式:
变暗:
变白:
出现液滴:
已知乳酸的结构简式为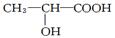 。试回答:
。试回答:
(1)乳酸分子中含有和两种官能团。
(2)乳酸跟氢氧化钠溶液反应的化学方程式:
(3)乳酸跟足量的金属钠反应的化学方程式:
(4)乳酸跟乙醇发生酯化反应生成的酯的结构简式为:
(5)相等的乳酸分别和足量的钠和碳酸氢钠反应生成气体的物质的量之比为
(9分)已知同一个碳原子上连有两个羟基是不稳定的,会失水形成羰基。试回答下列问题:
(1)写出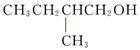 在Ag存在和加热条件下与O2反应的化学方程式:
在Ag存在和加热条件下与O2反应的化学方程式:
________________________________________。
(2)写出丙炔与HBr按1∶2的加成产物(氢原子加在含氢较多的碳上)在碱性条件下完全水解后产物的结构简式:_____________________________。
(3)C5H12O分子属于醇类的同分异构体有______种,若向其中加入酸性高锰酸钾溶液无明显现象,则该醇的结构简式为________________。