广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+和CO(NH2)2等。制备流程如图所示: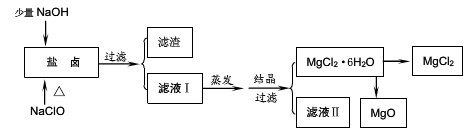
(1)滤渣的成分是______(填化学式);滤液Ⅱ中所含的主要杂质离子 (写离子符号)。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为________;加入NaClO还能起到的作用是______。
(3)直接将MgCl2·6H2O加强热能得到MgO,反应的化学方程式是_____。用MgCl2·6H2O制备无水MgCl2过程中,所需要的化学试剂是________。
(4)海水制溴过程中吸收潮湿空气中的Br2是利用SO2气体,SO2吸收Br2的离子方程式是_________________________________。SO2气体可来源于硫酸工业的尾气,同时,SO2尾气也可用氨水吸收,作为制备化肥的原料,SO2气体用氨水吸收得到的产物可能是________。
某液体化合物X2Y4,常用做火箭燃料。16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)===X2(g)+2Y2O(l)。冷却后标准状况下测得生成物的体积为11.2 L,其密度为1.25g/L,则:
(1)反应前O2的体积V(O2)为________。
(2)X2的摩尔质量为________;Y元素的名称是________。
(3)若反应生成0.1mol X2,则转移电子的物质的量为________mol。
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2,SiO2,CaO,MgO,Fe2O3,Na2O2按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①___________________________________________________;
②___________________________________________________。
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol/L的FeCl3溶液,可制得一种红褐色胶体。
①反应的化学方程式为_________________________________。
②如何用较简单的方法判断胶体是否制备成功?___________________________________。
(3)若向该胶体中加入饱和(NH4)2SO4溶液,发生的现象是_________________________;
原因是_______________________________________________。
浓H2SO4密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是
(1).若C=9.2则a>10 b>49%(2) 若C=9.2则a>10 b<49%
(3).若b=49则a=18.4 C<9.2(4) 若b=49则a=18.4 C>9.2
| A.(1) (3) | B.(1) (4) | C.(2) (3) | D.(2) (4) |
卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。
查阅资料如下:
①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3-+ I2 = 2IO3-+ Br2
③ IO3-+ 5I-+ 6H+ = 3I2 + 3H2O ④ 2IO3-+ 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 |
现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
一些杀菌、镇痛的药物可由植物的种子、根皮提炼得到,如丁香酚、丹皮酚,其结构如下:
请回答:
(1)丁香酚和丹皮酚都具有杀菌作用,其原因可能是含有 (填官能团的名称)。
(2)丁香酚和丹皮酚都能发生的反应类型为 (填字母序号)。
| A.加成反应 | B.加聚反应 | C.取代反应 | D.消去反应 |
(3)丁香酚发生聚合反应生成高分子的化学方程式为 。丁香酚发生反应如下图所示。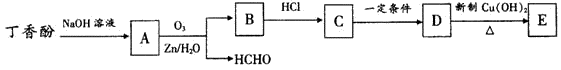

③丹皮酚在“一定条件”生成的物质与D互为同分异构体。
(4)丁香酚→A过程中加入NaOH溶液的原因是____ 。
(5)写出一种同时符合以下条件的D的同分异构体的结构简式: 。
a.苯环上连接两种基团 b.遇FeCl3溶液显示特征颜色
c.能发生银镜反应 d.核磁共振氢谱显示含有五种氢原子
(6)D→E反应的化学方程式为 。