铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列各题。
(1)所含铁元素既有氧化性又有还原性的物质是( )(用字母代号填)。
| A.Fe | B.FeCl3 | C.FeSO4 | D.Fe2O3 |
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中微粒直径的范围是____________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的化学方程式:__________________;检验反应后的溶液中存在Fe3+的试剂是_____________,该反应的离子方程式为__________________________。
石油和煤炭加工过程涉及多种技术和设备.
(1)石油分馏时,在不断向(填工业设备名称)内投放原料的同时获得产品,该过程为操作过程.
(2)石油裂化分为热裂化、和加氢裂化,裂化的目的是提高的产量.
(3)煤的洗选是为了降低原煤中灰分和的含量.煤的流化床燃烧是指空气从底部吹向煤炭颗粒,并使全部煤炭颗粒进行燃烧的过程.
(4)煤的直接液化是煤与适当溶剂混合后在高温和存在下与作用生成液体燃料的过程.
偏二甲肼与
是常用的火箭推进剂,二者发生如下化学反应:
(Ⅰ)
(1)反应(Ⅰ)中氧化剂是.
(2)火箭残骸中常现红棕色气体,原因为:
(Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为(填"吸热"或"放热")反应.
(3)一定温度下,反应(Ⅱ)的焓变为
.现将1
充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 .若在相同温度下,上述反应改在体积为1
的恒容密闭容器中进行,平衡常数(填"增大""不变"或"减小"),反应3
后
的物质的量为0.6
,则0~3
内的平均反应速率
=
.
(4)
可用氨水吸收生成
.25℃时,将
溶于水,溶液显酸性,原因是(用离子方程式表示).向该溶液滴加
氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将填"正向""不"或"逆向")移动,所滴加氨水的浓度为
.(
的电离平衡常数取Kb=2×10﹣5
)
工业上由黄铜矿(主要成分
)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的吸收.
a.浓
b.稀
c.
溶液 d.氨水
(2)用稀
浸泡熔渣B,取少量所得溶液,滴加
溶液后呈红色,说明溶液中存在(填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)以
溶液为电解质溶液进行粗铜(含
、
、
、
、
等杂质)的电解精炼,下列说法正确的是.
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中
向阳极移动
d.利用阳极泥可回收
、
、
等金属
(5)利用反应
可制备
,若将该反应设计为原电池,其正极电极反应式为 .
难溶性杂卤石(
)属于"呆矿",在水中存在如下平衡
⇌
为能充分利用钾资源,用饱和
溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
(1)滤渣主要成分有和以及未溶杂卤石.
(2)用化学平衡移动原理解释
溶液能溶解杂卤石浸出
的原因:.
(3)"除杂"环节中,先加入溶液,经搅拌等操作后,过滤,再加入溶液调滤液
至中性.
(4)不同温度下,
的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①②;

(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生: 已知298 时, =2.80×10﹣9, =4.90×10﹣5,求此温度下该反应的平衡常数 (计算结果保留三位有效数字).
过渡金属催化的新型碳﹣碳偶联反应是近年来有机合成的研究热点之一,如:
反应①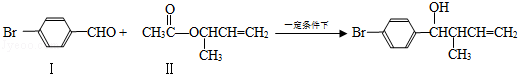
化合物Ⅱ可由化合物Ⅲ合成: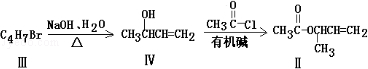
(1)化合物Ⅰ的分子式
(2)化合物Ⅱ与
加成的产物的结构简式为
(3)化合物Ⅲ的结构简式为
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应的方程式为(注明反应条件),因此,在碱性条件下,由Ⅳ与
反应生成Ⅱ,其反应类型为.
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ与Ⅱ也可以发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为(写出其中一种).