以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: 
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)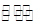 2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为____________________________。
2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为____________________________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是______________.______________。
(3)通氯气氧化时,发生的主要反应的离子方程式为________________________;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为____________(写化学式)。
.(6分)已知2Na+2H2O====2NaOH+H2↑ ,该反应中氧化剂为,被氧化的物质是,若生成H2的体积为11.2L(标准状况),则该反应中转移的电子数目为。
3.01×1023个HCl分子的物质的量是,其在标准状况下的体积为,将其溶于水配成2L溶液,所得溶液的物质的量浓度为。
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
2SO2(g)+O2(g) 2SO3(g)△H=―190 kJ·mol—1
2SO3(g)△H=―190 kJ·mol—1
(1)该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
(2)450℃时,在一2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是
(3)据图判断,反应进行至20min时,曲线发生变化的原因是___________________(用文字表达),10min到15min的曲线变化的原因可能是(填字母)。
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3物质的量 |
(4)欲提高SO2的转化率,下列措施可行的是______。
(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(5)利用图中数据计算450℃时反应进行至15min时,SO2的平衡转化率为:。
(6)450℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(SO2)=0.4mol,n(O2)=0.2mol,n(SO3)=0.8mol,则此时该反应向进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
已知如图所示的可逆反应: A(g)+B(g) 2C(g) +D(g);ΔH =" Q" kJ/mol
2C(g) +D(g);ΔH =" Q" kJ/mol
请回答下列问题:
(1)Q0(填“>”、“<”或“=”)
(2)在某温度下,反应物的起始浓度分别为:c(A)=" 1.0" mol/L, c(B)="2.0" mol/L ;达到平衡后,A的转化率为50%,此时B的转化率为;
(3)若反应温度升高,A的转化率(填“增大”“减小”或“不变”);
(4)若反应温度不变,反应物的起始浓度分别为:c(A)=" 3" .0mol/L,
c(B)=" a" mol/L;达到平衡后,c(D)="1.0" mol/L,a=;
(5)反应体系中加入催化剂,反应速率增大,则E1的变化是:E1_______,ΔH的变化是:ΔH________(填“增大”“减小”“不变”)。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。
(1)在250C、101KPa时,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,则能表示甲醇燃烧的热化学方程式为___________________。
(2)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②下列措施中能使n(H2O)/n(CO2)增大的是________。
A.升高温度 B.再充入3mol H2
C.将CH3OH (g)从体系中分离 D.充入He(g),使体系压强增大