常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,该溶液pH一定为14-a
B.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:
3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液: c(HA)>C(Na+)>c(A-)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X,Y不可能是:
| 选项 |
X |
Y |
| A |
SO2 |
H2S |
| B |
Cl2 |
CO2 |
| C |
NH3 |
CO2 |
| D |
SO2 |
Cl2 |
已知NH3和HCl都是能用来做喷泉实验的气体。若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示。喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑烧瓶内溶质的扩散,氨水的溶质按NH3计算)
| A.溶质的物质的量浓度相同、溶质的质量分数不同 |
| B.溶质的质量分数相同、溶质的物质的量浓度不同 |
| C.溶质的物质的量浓度和溶质的质量分数都不同 |
| D.溶质的物质的量浓度和溶质的质量分数都相同 |
下列物质转化在给定条件下能实现的是:
①Al2O3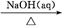 NaAlO2(aq)
NaAlO2(aq)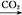 Al(OH)3
Al(OH)3
②S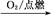 SO3
SO3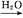 H2SO4
H2SO4
③NaOH(aq)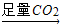 NaHCO3
NaHCO3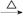 Na2CO3
Na2CO3
④Fe2O3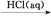 FeCl3(aq)
FeCl3(aq)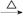 无水FeCl3
无水FeCl3
⑤NH4Cl(s) NH3
NH3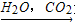 NH4HCO3
NH4HCO3
| A.①③⑤ | B.①④⑤ | C.②③④ | D.②④⑤ |
将一定量硫酸、硝酸和KNO3溶液混合成100mL溶液,其中H2SO4、HNO3和KNO3的物质的量浓度分别是6mol/L,2mol/L和1mol/L,向其中加入过量的铁粉,可产生标准状况下的混合气体体积为
| A.11.2 L | B.6.72 L | C.8.96 L | D.4.48 L |
下列离子方程式正确的是:
| A.过量氯气通入溴化亚铁溶液中:Fe2++2Br-+2Cl2=Fe3++Br2+4Cl- |
| B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O |
| C.碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++ OH—+HCO3—=CaCO3↓+ H2O |
| D.用FeCl3溶液腐蚀印刷电路板:Cu+Fe3+=Fe2++Cu2+ |