元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是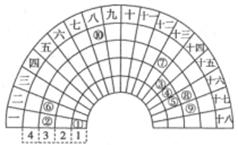
| A.⑥、⑧、⑨对应单核离子的半径依次增大 |
| B.⑤的三种核素的化学性质不相同 |
| C.④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 |
| D.⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
下列关于电解质溶液的叙述正确的是( )
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为: c(Cl-)>c(NH  )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1 mol·L-1的甲酸溶液的c(H+)为1×10-2 mol·L-1 |
| B.甲酸能与水以任意比互溶 |
| C.10 mL 1 mol·L-1的甲酸恰好与10 mL 1 mol·L-1的NaOH溶液完全反应 |
| D.滴入石蕊试液显红色 |
在0.1 mol·L-1的HCN溶液中存在如下电离平衡HCN H++CN-。对该平衡,下列叙述正确的是( )
H++CN-。对该平衡,下列叙述正确的是( )
| A.加入少量NaOH固体,平衡向正反应方向移动 |
| B.加水,平衡向逆反应方向移动 |
| C.滴加少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减少 |
| D.加入少量NaCN固体,平衡向正反应方向移动 |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g) 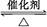 2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )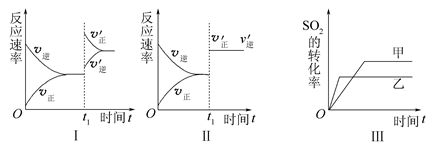
| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
在25mL碱式滴定管中盛放KOH溶液,将溶液的凹面调至“0”刻度后,再把其中的液体全部放出,则流出液体体积( )
| A.25mL | B.大于25mL | C.小于25mL | D.都不正确 |