S2Cl2是一种易挥发的液体(熔点:-76℃,沸点:138℃),且易与水发生水解反应,可能生成H2S、SO2、H2SO3、H2SO4等物质。它是橡胶硫化剂。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。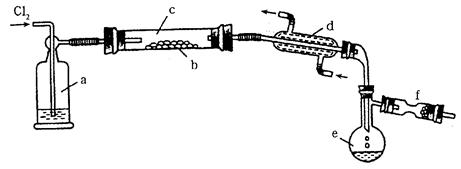
(1)已知S2Cl2分子结构与H2O2相似,则S2Cl2的分子中共含有__________条共价键。
(2)装置a中应放试剂为__________;装置d的名称是_________,它的作用是_________。
(3)该实验的操作顺序应为__________(用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)图中f装置中应放置的试剂为__________,其作用为_____________。
(5)将S2Cl2的水解气体产物通入氯水中,若观察到_________的现象,则可证明水解产物中有硫化氢生成。
(8分)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1.2 mol,试完成下列问题:
(1)烃A的分子式是_________。
(2)若取一定量的烃A充分燃烧后,生成B、C各3 mol,则有_________g的A参加了反应,燃烧时消耗标准状况下的氧气_________ L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式是___________。
(4)若烃A能使溴水褪色,在催化剂作用下与H2发生加成反应后生成2,2-二甲基丁烷,则烃A的名称是_________,结构简式是_________。
(5)比A少两个碳原子的A的烯烃同系物的同分异构体共有_________种。
(8分)有人设计溴苯的制取装置如下图所示,请按要求完成下列问题: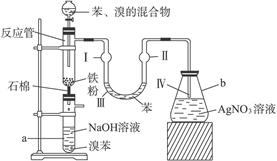
(1)反应式为_____________________________________________。
(2)在滴入混合液几分钟后,能观察到的现象是:
(Ⅰ)处______________________;
(Ⅱ)处______________________;
(Ⅲ)处______________________;
(Ⅳ)处______________________。
(3)在2 min—3 min后,可以在a管底部得到_________。
(4)NaOH的作用是______________________;
U形管中苯的作用是____________________;
AgNO3溶液的作用是____________________。
(5)a管带有支管,其作用为___________________;
为加强此作用,还可在支管口处进行的操作是______________________。
某学生设计了下述实验室分馏石油的实验,分为五个步骤。
①将蒸馏烧瓶放在铁架台上,在蒸馏烧瓶上塞好带温度计的橡胶塞。
②连接好冷凝管,把冷凝管固定在铁架台上,将冷凝管的一端和水龙头连接,将出水口一端的橡胶管放入水槽中。
③把酒精灯放在铁架台上,根据酒精灯高度调整铁圈的高度,放好石棉网。
④向蒸馏烧瓶中放入碎瓷片,再用漏斗向烧瓶中加入原油,塞好带温度计的塞子,将牛角管接在冷凝管的末端,并深入锥形瓶中。
⑤检查气密性。
正确的操作顺序是( )
| A.②①③⑤④ |
| B.③①②⑤④ |
| C.①②③④⑤ |
| D.⑤④③②① |
某学生设计了下述实验室分馏石油的实验,分为五个步骤。
①将蒸馏烧瓶放在铁架台上,在蒸馏烧瓶上塞好带温度计的橡胶塞。
②连接好冷凝管,把冷凝管固定在铁架台上,将冷凝管的一端和水龙头连接,将出水口一端的橡胶管放入水槽中。
③把酒精灯放在铁架台上,根据酒精灯高度调整铁圈的高度,放好石棉网。
④向蒸馏烧瓶中放入碎瓷片,再用漏斗向烧瓶中加入原油,塞好带温度计的塞子,将牛角管接在冷凝管的末端,并深入锥形瓶中。
⑤检查气密性(利用给固定装置微热的方法)。
正确的操作顺序是()
| A.②①③⑤④ |
| B.②③①⑤④ |
| C.①②③④⑤ |
| D.⑤④③②① |
聚氯乙烯是用途十分广泛的石油化工产品,某化工厂曾利用下列工艺生产聚氯乙烯的单体氯乙烯:
CH2CH2+Cl2→CH2Cl—CH2Cl ①
CH2Cl—CH2Cl→CH2CHCl+HCl ②
请完成以下问题:
(1)已知反应①中二氯乙烷的产率(产率= ×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯_______________t;同时得到副产物氯化氢_______________t。(计算结果保留1位小数)
×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯_______________t;同时得到副产物氯化氢_______________t。(计算结果保留1位小数)
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
2CH2CH2+4HCl+O2→2CH2Cl—CH2Cl+2H2O ③
由反应①③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新的工艺。
由于副反应的存在,生产中投入的乙烯全部被消耗时,反应①③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%。试计算:
反应①③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也不消耗氯化氢)。