在密闭容器中,反应N2(g)+3H2(g)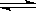 2NH3(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
2NH3(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
| A.加入适当催化剂 | B.升高温度 | C.增大反应物的浓度 | D.增大压强 |
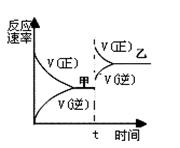
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
下列各组溶液混合后,溶液的PH一定大于7的是
| A.含等物质的量的KOH、MgSO4、NH3·H2O溶液混合 |
| B.pH= 2的盐酸和 pH=12的氨水等体积混合 |
| C.pH= 3的某酸和 pH= 11的某碱等体积混合 |
| D.pH=2的CH3COOH和pH=12的NaOH溶液等体积混合 |
室温,把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混合,则混合液中微粒浓度关系正确的为
| A.c (CH3COO-)>c (Na+) |
| B.c (OH-)>c (H+) |
| C.c (CH3COOH)>c (CH3COO-) |
| D.c (CH3COOH)+c (CH3COO-)=0.02mol/L |
滴有酚酞和氯化钠试液滤纸分别做甲、乙两个实验,能发现附近变成红色的电极是
| A.ac | B.bd | C.ad | D.bc |
可逆反应N2+3H2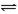 2NH3是一个放热反应。甲、乙是完全相同的容器,甲容器中加入1molN2和3 molH2,一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率
2NH3是一个放热反应。甲、乙是完全相同的容器,甲容器中加入1molN2和3 molH2,一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率
| A.20% | B.25% | C.75% | D.80% |