在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)===CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a. 容器中压强不变 b. 混合气体中c(CO)不变
c. v正(H2)=v逆(H2O) d. c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_ (3’)
日常生活中,可用明矾[KAl(SO4)2·12H2O]作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质。写出水解反应的离子方程式为:
pH = 2与pH = 5的两强酸溶液各10 mL,混合后溶液的pH为。
纯水在20 ℃的pH(填“大于”或“小于”)80 ℃时的pH。
可逆反应: 根据图回答:
根据图回答: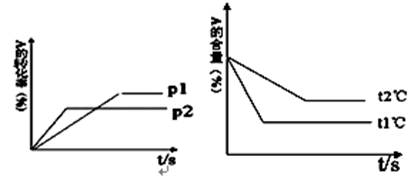
(1)压强 P1比P2(填“大”或“小”);
(2)(a +b)比(c +d)(填“大”或“小”);
(3)温度t1℃比t2℃(填“高”或“低”);
(4)正反应为反应(填“吸热”或“放热”);
DAP-A树脂(下列路线图中的β、γ聚合物)是一种优良的热固性树脂,被用作高级UV油墨的一种成分。用UV油墨印刷的优点是:印刷时油墨极快干燥,对环境及人员无损害,性价比较高。因此,适于大规模生产食品、酒类、洗涤剂等包装纸盒。以下是以石油化工产品为原料,合成该材料的路线: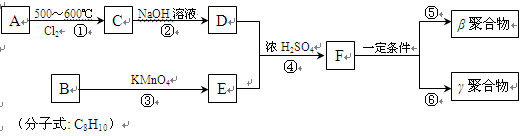
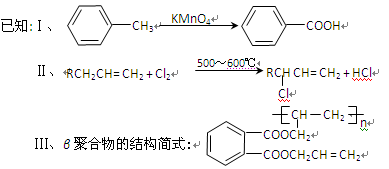
试回答下列问题:
(1)A的名称是 。
(2)在①~④的反应中属于取代反应的是 。
(3)B的结构简式是 ,B苯环上的二氯代物有 种。
(4)写出反应④的化学方程式:
。
(5)工业上可由C经过两步反应制得甘油(丙三醇),写出第二步反应的化学方程式
。
(6)γ聚合物和β聚合物相比,下列说法合理的是 。
| A.它们互为同分异构体 | B.它们含碳的质量分数相同 |
| C.γ聚合物中可能几乎不含碳碳双键 | D.不能发生水解反应 |