聚合硫酸铁又称聚铁,化学式为 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是___。
(2)制备绿矾时,向溶液X中加入过量___,充分反应后,经_____操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为____。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____。
(4)古代将绿矾煅烧可制绿矾油(也叫镪水,即硫酸)和红色颜料(Fe2O3),请写出有关的化学方程式:
。
(5)绿矾还可用以下方法生产红色颜料(Fe2O3),其具体操作流程是:将5560kg绿矾(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入16680 kg 绿矾和560 kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料____________________kg。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·H2O),过程如下: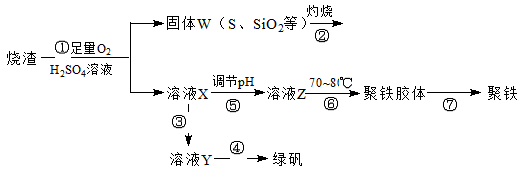
请回答下列问题:
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式:。
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是。
| A.品红溶液 | B.紫色石蕊试液 | C.酸性高锰酸钾溶液 | D.溴水 |
(3)过程③中,需要加入的物质是(化学式)。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是。
已知:常温常压下,D、E、F、I、J为气体; 1molE与含1molF的水溶液恰好反应生成B。B是一种常见的化肥。物质 之间有如下图所示转化关系(部分反应中生成的水已略去)。
之间有如下图所示转化关系(部分反应中生成的水已略去)。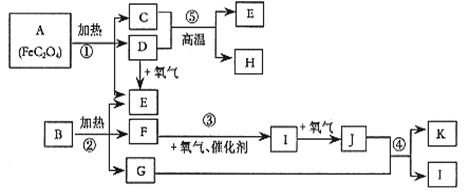
试回答下列问题:
(1)已知A中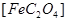 和C中Fe元素均为+2价,则
和C中Fe元素均为+2价,则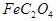 中碳元素的化合价为______
中碳元素的化合价为______
(2)B的化学式为___________________。
(3)写出反应③的化学方程式 _______________________ _____。
(4)写出过量单质H与K的稀溶液反应的离子方程式:_____________________。
2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Cu2+、Al3+ |
| 阴离子 |
SO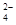 、HCO 、HCO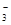 、NO 、NO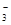 、OH- 、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象写出下列物质化学式:ABCDE
(9分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: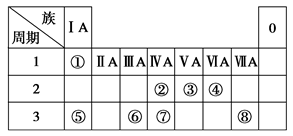
(1)画出⑧原子结构示意图__________ __
(2)④、⑤、⑥的简单离子半径由大到小的顺序是________。
(用离子符号表示)
(3)①-⑧的元素中,某元素气态氢化物与其最高价氧化物对应的水化物反应所得生成物溶于水,溶液呈酸性,原因是__________________________ _(用离子方程式表示),该氢化物分子空间结构为______ _
(4)写出由元素⑥组成的单质与元素⑤最高价氧化物对应的水化物的水溶液反应的离子方程式_________________________ _
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:(H-1 O-16 Fe-56)
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有_______、_____(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式____________________________。
(3)检验沉淀是否已经洗涤干净的操作是_____________________________。
(4)该实验中可以回收利用的物质是________________________________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是___(列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____(写出一种原因即可)。
(6)为进一步探究样品的性质,他们又利用溶液A做了如下一些实验,其中现象、结论均正确的_
______________(填写序号)。
A.向氢氧化镁悬浊液中滴加A溶液出现红褐色沉淀,证明 |
| B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色由黄色变成浅绿色 |
| C.向沸水中滴加A的饱和溶液,立即出现红褐色沉淀 |
| D.将A溶液加热蒸干并灼烧,得到Fe2O3固体 |