含1 mol Ba(OH)2的稀溶液与足量稀盐酸反应,放出热量114.6 kJ。下列热化学方程式中正确的是( )
| A.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) ΔH=+114.6 kJ/mol |
| B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) ΔH=-114.6 kJ/mol |
C.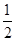 Ba(OH)2(aq)+HCl(aq)= Ba(OH)2(aq)+HCl(aq)=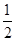 BaCl2(aq)+H2O(l) ΔH=-57.3 kJ/mol BaCl2(aq)+H2O(l) ΔH=-57.3 kJ/mol |
D.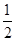 Ba(OH)2(aq)+HCl(aq)= Ba(OH)2(aq)+HCl(aq)=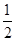 BaCl2(aq)+H2O(l) ΔH=+57.3 kJ/mol BaCl2(aq)+H2O(l) ΔH=+57.3 kJ/mol |
常温下,已知:
4Al(s)+3O2(g)=2Al2O3(s)ΔH1
4Fe(s)+3O2(g)=2Fe2O3(s)ΔH2
下面关于ΔH1、ΔH2的比较正确的是( )
| A.ΔH1>ΔH2 | B.ΔH1<ΔH2 |
| C.ΔH1=ΔH2 | D.无法计算 |
火电厂利用燃煤发电,煤燃烧中的热化学方程式有:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
CO(g)+ O2(g)=CO2(g)ΔH2=-283 kJ/mol
O2(g)=CO2(g)ΔH2=-283 kJ/mol
C(s)+ O2(g)=CO(g)ΔH3=?
O2(g)=CO(g)ΔH3=?
下列有关说法中不正确的是( )
| A.CO的燃烧热为283 kJ/mol |
| B.二氧化碳分解为一氧化碳和氧气的反应是吸热反应 |
| C.ΔH3=ΔH2-ΔH1=110.5 kJ/mol |
| D.ΔH3=ΔH1-ΔH2=-110.5 kJ/mol |
下列关于热化学反应的描述中正确的是( )
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol |
| B.碳与二氧化碳的反应既是吸热反应,又是化合反应 |
| C.热化学方程式中化学计量数可表示分子个数 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
已知H—H键的键能为436 kJ/mol,O=O键的键能为498 kJ/mol,根据热化学方程式H2(g)+ O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
| A.485.5 kJ/mol | B.610 kJ/mol |
| C.917 kJ/mol | D.1 220 kJ/mol |