下表为元素周期表的一部分,A、B、D、E、G、L、Q为部分元素。其中L的单质在人类的生产和生活中有着十分重要的作用,Q的化合物可以有黑色、红色、蓝色、白色等多种颜色。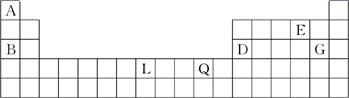
(1)请回答下列问题:
①写出G-的结构示意图:________。
②元素L在周期表中的位置:________。
③元素Q的单质为红色,写出单质Q在空气中生锈的化学方程式:_______________。
(2)由A、D、E、G、L五种元素组成的物质[DL(EA)nG6-n]m(其中m、n为正整数,n<5、m<10)广泛应用于日常生活用水和工业污水的处理。某化工厂以工业生产废料(D、L的单质及其氧化物)为原料制取[DL(EA)nG6-n]m,设计的生产流程如下:
①选用的试剂X应为________。
②下列关于[DL(EA)nG6-n]m的说法正确的是________(填序号)。
A.该物质中L元素的化合价为+2
B.该物质在熔融态不导电
C.该物质在强酸和强碱性溶液中均不能稳定存在
D.该物质溶于水能电离出(EA)离子,是一种碱
③写出上述流程的酸性溶液中加入BGE3时,发生反应的离子方程式:_______________。
已知乙烯能发生以下转化:
(1)聚乙烯的结构简式为:__________,化合物C所含官能团的名称为________。
(2)写出下列转化的化学方程式(标明反应条件)和反应类型
A→B:___________,反应类型:__________。
(3)已知 ,写出反应②的反应方程式(标明反应条件):_____________。
,写出反应②的反应方程式(标明反应条件):_____________。
(4)乙酸乙酯有一种同分异构体D,D也属于酯类,并且可以跟新制Cu(OH)2悬浊液混合煮沸生成砖红色沉淀,试写出D的一种结构简式:___________。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g)△H,随温度升高,混合气体的颜色变深。
2NO2(g)△H,随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,平均反应速率v(NO2)为 mol·L-1·s-1,反应的平衡常数K为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”或“小于”)。
(3)利用图(a)和(b)中的信息,按图(b)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_____________。

硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
已知:某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
| Mg(OH)2 |
9.3 |
10.8 |
| Fe(OH)2 |
7.6 |
9.6 |
| Fe(OH)3 |
2.7 |
3.7 |
| Al(OH)3 |
3.7 |
4.7 |
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:______、_____。
(2)加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O = MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为 。
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩, 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
(5)实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,计算MgSO4·7H2O的产率为 (保留两位有效数字)。
(6)金属镁可用于自然水体中铁件的电化学防腐,完成下图防腐示意图,并作相应标注。
完成下列反应的离子方程式
(1)Ba(OH)2溶液加入过量NaHCO3溶液_____。
(2)NaClO溶液中通入少量CO2_____。
(3)将Fe(NO3)3溶液与过量HI混合_____。
(4)向FeBr2中通入等量Cl2_____。
(1)若40g密度为ρ g·cm-3的Ca(NO3)2溶液中含有4 g Ca(NO3)2,则溶液中NO的物质的量浓度为 mol/L
(2)在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为 mol/L
(3)NA代表阿伏加德罗常数。已知C2H4和C3H6的混合物的质量为a g,则该混合物所含共用电子对数目为_____,所含碳氢键数目为_____。