(Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应。10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为 。
(2)下图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式 。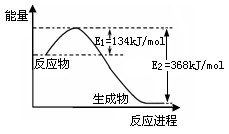
(3)NH3(g)燃烧的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)==2H2O(l) △H=" -483.6" kJ/mol
N2(g)+2O2(g)==2NO2 (g) △H="+67.8" kJ/mol
N2(g)+3H2(g)==2NH3 (g) △H="-92.0" kJ/mol
请计算NH3 (g)的燃烧热 。
| 温度 |
平衡浓度/ (mol L-1) |
|
| c(NH3) |
c(CO2) |
|
| T1 |
0.1 |
|
| T2 |
|
0.1 |
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s) 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
(Ⅱ)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
| Cl- |
18980 |
Ca2+ |
400 |
| Na+ |
10560 |
HCO3- |
142 |
| SO42- |
2560 |
Br- |
64 |
| Mg2+ |
1272 |
|
|
 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
(1)阳极主要电极反应式是 。
(2)在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程
式是 。
(3)淡水的出口为 (填“a”、“b”或“c”)。
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写元素符号:A为 ,B为 ,C为 。
D的最高价氧化物的水化物化学式是。
(2)写出A、B形成的化合物与E反应的化学方程式: 。
(3)E属(“离子”或“共价”)化合物。E中含键。
(4)D元素在周期表中位于第_____周期______族。
已知A、B、C、D为气体(其中A为黄绿色),E是常见的氮肥,F为固体,G是氯化钙,它们之间的转换关系如下图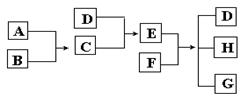
⑴ D的结构式是_____________,E的化学式(分子式)是_____________。
⑵ D和O2反应的化学方程式是______________________________。
⑶ E和F反应生成D、H和G的化学方程式是___________________________________。
⑴完成下列物质的电子式:
KOH; H2S;
CS2; NH4Cl;
⑵下列微粒之间,属于同位素的是,(填序号,下同)属于同素异形体的是,属于同分异构体的是,固体时属于原子晶体的是。
| A.正丁烷与异丁烷 |
| B.红磷与白磷 |
| C.氕与氚 |
| D.氯化钠与干冰 |
E.金刚石与水晶
F.氧气和臭氧
G. 13C和14C
H.CH3OCH3和CH3CH2OH
⑶亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+KIO3+H2SO4——Na2SO4+K2SO4+I2+H2O
(a)配平上面的氧化还原反应方程式,将系数填入方框中。
(b)其中氧化剂是,若反应中有5 mol电子转移,则生成的碘是mol。
①NaCl、②干冰、③冰、④Na2O2、⑤白磷(P4)、⑥金刚石、⑦Na2CO3、⑧钠。以上物质中属于离子晶体的是 ________ ;属于分子晶体的是(填序号)。氯化钡是无色晶体,溶于水,水溶液能导电,熔点1 560 ℃。它可能属于 ______ 晶体。
如图所示,把试管小心地放入盛有(20 ℃)碳酸饮料的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5 mL稀盐酸于试管中。试回答下列问题: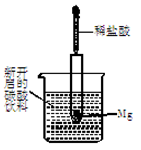
(1)实验中观察到的现象是_________________________________________________。
(2)产生上述现象的原因是___________________________________。
(3)写出有关反应的离子方程式 _____________________。
(4)由实验推知,MgCl2溶液和氢气的总能量(填“大于”“小于”或“等于”)镁片和盐酸的总能量。