(Ⅰ)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
;K值大小与温度的关系是:温度升高,K值
(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)某温度下,将CO和水蒸气各1mol置于密闭容器中反应,达到平衡后测得CO2为0.6mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量的范围是__________。
Ⅰ.在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________
(2)A的转化率为_________________
(3)生成D的反应速率为_________________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 _________
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各 mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol.
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol.
Ⅱ.恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=。
(2)反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的体积分数为25%。则平衡时NH3的物质的量为。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=____________________________。
(4)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=________。
(每空2分,共6分)依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为________________________________________________。
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热为-57.3kJ/mol): ___________________________________________________。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -19.5kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式
某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A +3B 2C,若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中C气体的体积占 10%,下列推断正确的是
2C,若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中C气体的体积占 10%,下列推断正确的是
①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL
③反应达平衡时,气体A消耗掉0.05VL ④反应达平衡时,气体B消耗掉0.05V L
| A.②③ | B.②④ | C.①③ | D.①④ |
从海水中可以获得淡水、食盐,也可提取镁和溴等物质。
(1)海水淡化的方法主要有______(填一种)。
(2)从海水中提取镁的流程如下图所示: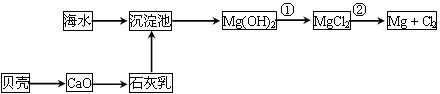
流程中分离Mg(OH)2沉淀的方法是_____________________;
写出反应②的化学方程式____________________________。
(3)从海水中提取溴的主要反应原理是向浓缩的海水中通入氯气,将溴离子氧化。试写出该反应的离子方程式________________________________________________。
现有A、B、C三种短周期元素,其原子序数依次递增;A与C的质子数之和为27,最外层电子数之差为5;B元素的内层电子数之和是最外层电子数的5倍。请回答下列问题:
(1)写出C的名称。
(2)A、C形成的化合物的电子式为______________________________。
(3)A、B最高价氧化物对应的水化物的酸性或碱性由强至弱的顺序是(用化学式表示)。
(4)A、C最高价氧化物对应的水化物之间可以发生反应,写出该反应的离子方程式。
(5)C的某种氧化物是常见的大气污染物,为消除该污染物,某工厂用NaOH溶液、生石灰和O2处理含该氧化物的尾气并最终使其转化为石膏(CaSO4·2H2O)。试用一道化学方程式表示上述转化___________。