现有下列物质:
①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸
⑤FeCl3溶液 ⑥铜 ⑦ Fe(OH)3胶体 ⑧蔗糖,
(1)其中属于电解质的是 ,
(2)写出FeCl3的电离方程式:__________________________,
(3)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:_____________________,
(4)胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,
停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做胶体的聚沉。
③区分胶体和溶液常用的方法叫做 。
a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)、写出下列粒子的电子式:
①c__________;②d__________;③e__________;④a__________。
(2)、b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:__________>__________(用化学式表示)。
(3)、用电子式表示b元素与氧形成的化合物b2O的形成过程:________________。
苯环上原有的取代基对新导入苯环上的取代基的位置有一定影响,其规律是:
①苯环上新导入的取代基所占的位置主要决定于原有取代基的性质。
②可以把原有取代基分成两类:第一类如:―OH,―X(Cl,Br), ,—R等,可使新导入的取代基进入苯环的邻位和对位;第二类如—NO2、—SO3H、—CHO等,可使新导入的取代基进入苯环的间位。当第一类和第二类同时存在时,以第一类为准。
,—R等,可使新导入的取代基进入苯环的邻位和对位;第二类如—NO2、—SO3H、—CHO等,可使新导入的取代基进入苯环的间位。当第一类和第二类同时存在时,以第一类为准。
(1)请写出图中第②步反应的化学方程式及C的结构简式。
②的化学方程式是。
(2)C的结构简式为。
(3)写出同分异构体D,E的结构简式:D;E。
航天飞机常用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-==CO32-+3H2O。
(1)负极上的电极反应为。
(2)消耗16.8 L(标准状况下)O2时,有mol 电子发生转移。
(3)开始放电时,正极附近溶液的氢氧根离子浓度(填“增大”、“减小”或“不变”)。
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水;D元素原子的次外层电子数比最外层电子数多4,E元素原子的最外层与最内层电子数的差是3。试回答下列问题:
(1)写出下列元素符号:A,C,D,E。
(2)用电子式表示B和F形成化合物的过程:。
(3)写出A、C、F三种元素最高价氧化物对应的水化物相互反应的化学方程式:
、、。
某有机物A既能使溴水褪色,又能与碳酸钠溶液反应放出CO2,A与CnH2n+1OH反应生成分子式为Cn+3H2n+4O2的酯。回答以下问题:
(1)A的分子式为,结构简式为。
(2)已知含碳碳双键的有机物与卤代氢发生加成反应,卤代氢中的氢原子加到氢原子较多的不饱和碳原子上,而卤原子加到含氢原子较少的不饱和碳原子上,依此规则,A与HBr发生加成反应,生成物B的结构简式为。
(3)B与NaOH溶液发生取代反应后,再用盐酸酸化所生成C的结构简为: ,则C在浓硫酸的作用下,发生分子间脱水生成链状酯的化学方
,则C在浓硫酸的作用下,发生分子间脱水生成链状酯的化学方
程式为。
(4)C在浓硫酸作用下,生成的环状酯的结构简式为。
(5)写出一个与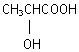 有相同官能团的同分异构体。
有相同官能团的同分异构体。