在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.25 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.25 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)下列选项中,符合“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度的试算式的是 。
A.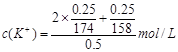
B. .
.
C.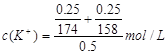
D.
(3)配制上述“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、________________、______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。 ,试回答:
,试回答:
⑴ 若X是强氧化性单质,则A不可能是_______________(可多选)。
A. S B. N2 C. Na D. Mg E. Al
⑵ 若A、B、C为含有同种金属元素的无机化合物,X为强电解质,A溶液与C溶液反应可生成B,则B的化学式可能为________,X的化学式可能为 或(填不同类型的物质),反应①的离子方程式为 或_____________________ 。
。
工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g~0.5g。已知NaNO2能发生如下反应:2NO + xI-+ yH+= 2NO↑+ I2 + zH2O,请回答下列问题:
+ xI-+ yH+= 2NO↑+ I2 + zH2O,请回答下列问题:
(1)上述反应中,x的数值是,y的数值是。
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现
有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为。
(3)某工厂废切削液中 含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列
含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列
物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为:。
以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识.按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是________________________________
(2)D组物质包括_
 _______________________(填化学式)o
_______________________(填化学式)o
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为________________
(4)F组物质中某一物质的水溶液呈弱碱性,用电离方程式表示呈弱碱性的原因: _____ ___
___
(5)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式: ____ ___________________
___________________
(11分)
(1)已知H2(g)+Br2(1) 2HBr(g)△H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
2HBr(g)△H=-72kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 键能/kJ·mol-1 |
436 |
a |
369 |
①Br2(1)=Br2(g)△H1,则△H1=_____________;
②写出H2(g)与Br2(g)反应生成HBr(g)的热化学方程式:_____________________________
③试计算a=_________________。
(2)磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在一定量氧气中燃烧生成P2O3、P2O5各0.025mol,反应物完全耗尽,并放出X kJ热量。
①已知1mo l磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。
l磷完全燃烧生成稳定氧化物放出的热量为Y kJ,则1molP与O2反应生成固态P2O3的反应热△H=________________________________。
②写出1mol P与O2反应生成固态P2O3的热化学方程式:
___________________________________________________________________
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成 原电池的是。
原电池的是。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中
电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4溶液
则阳极的电极反应式为,电解时的化学反应方程式为,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此 装置电解精炼铜,做阳极,电解液CuSO4的浓度
装置电解精炼铜,做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做,电镀液的浓度(填“增大”、“减小”或“不变”)。