工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。下图为阳离子交换膜法电解原理示意图:
请回答下列问题: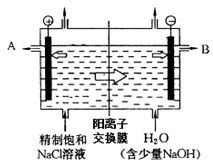
(1)A极为电解槽的________极,B极的材料工业上常采用的是生活中常见的金属,但有大量损耗,其主要原因是 。(填“吸氧腐蚀”或“析氢腐蚀”)
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的__________通过(填写下列微粒的编号)。
①H2,②Cl2,③H+,④Cl-,⑤Na+,⑥OH-。
(3)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH-==5Cl-+ClO3-+3H2O),下列说法正确的组合是 。
| A.电解结束时,右侧溶液中含有ClO3— |
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O  NaClO3 + 3H2↑ NaClO3 + 3H2↑ |
| C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样 |
| D.用阴离子交换膜后,阳离子的定向移动方向与原来相反 |
(4)已知某电解槽每小时加入10%的氢氧化钠溶液a kg,每小时能产生标准状况下的氯气b L,则电解后流出的氢氧化钠溶液(密度为d g·cm-3)的物质的量浓度为(理论计算,需化简) mol/L。
以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,用化学沉降法处理含砷废水,相关数据如下表。
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=mol·L-1。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为。
(14分)氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应:C(s)+H2O(g) CO(g) + H2(g);
CO(g) + H2(g);
② 用天然气跟水蒸气反应:CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知有关反应的能量变化如下图,且方法②的反应为吸热反应,则方法②中反应的ΔH =___________kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)  2NH3(g)
2NH3(g)
按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
c2 |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t5min,表中c1c2。(填“>”、“<” 或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)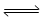 CO(NH2)2(s)+H2O(g)。工业生产时,原料气带有水蒸气。图1表示CO2的转化率与氨碳比
CO(NH2)2(s)+H2O(g)。工业生产时,原料气带有水蒸气。图1表示CO2的转化率与氨碳比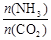 、水碳比
、水碳比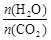 的变化关系。
的变化关系。
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是。
②测得B点氨的转化率为30%,则x1=。
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。
电池正极的电极反应式是,A是。
[化学——选修3:物质结构与性质] 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。请填写下列空白。
(1)e元素基态原子的核外电子排布式为____________。
(2)b、c、d三种元素的第一电离能数值由小到大的顺序为____________(填元素符号),其原因是__________________。
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键,又含有非极性共价键的化合物是(填化学式,写出两种)。
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲________,乙;甲高温易转化为乙的原因是__________________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图丙所示)。该化合物中,阴离子为,该化合物加热时首先失去的组分是,判断理由是。
[化学——选修2:化学与技术]铁、铝是现代金属材料的主角。但其腐蚀造成很大的经济损失,寻求金属制品抗腐蚀处理的方法意义重大。
(1)一种钢铁防腐的方法是将钢铁放在冷的浓硝酸中浸泡。但是加热或在稀HNO3中,铁与硝酸会不断反应。不同浓度的 HNO3与铁反应的还原产物很复杂,其分布曲线如图。
①钢铁在冷的浓硝酸中浸泡能防腐的原因是:。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是:。
③由图示可知,密度等于1.35 g/mL 的硝酸与铁反应时,其还原产物主要是; 请用一句话概括该图反映出的基本结论。
(2)以下为铝材表面处理的一种方法
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的。
a.NH3 b.CO2 c.NaOHd.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为。电解后的铝材再经氨洗的目的是。
③取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是。
硝基苯甲酸乙酯在OH — 存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
(1)列式计算该反应在120~180s与330~530s区间的平均反应速率__________,__________;比较两者大小可得出的结论是______________________________。
(2)列式计算该温度下反应的平衡常数____________________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,可以采取的措施有_______________(要求写出两条)。
(4)硝基苯甲酸乙酯有种,其中苯环上的一氯代物最少的结构简式为。