[化学——选修2:化学与技术]铁、铝是现代金属材料的主角。但其腐蚀造成很大的经济损失,寻求金属制品抗腐蚀处理的方法意义重大。
(1)一种钢铁防腐的方法是将钢铁放在冷的浓硝酸中浸泡。但是加热或在稀HNO3中,铁与硝酸会不断反应。不同浓度的 HNO3与铁反应的还原产物很复杂,其分布曲线如图。
①钢铁在冷的浓硝酸中浸泡能防腐的原因是: 。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
③由图示可知,密度等于1.35 g/mL 的硝酸与铁反应时,其还原产物主要是 ; 请用一句话概括该图反映出的基本结论 。
(2)以下为铝材表面处理的一种方法
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为 。电解后的铝材再经氨洗的目的是 。
③取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是 。
牛奶放置时间长了会变酸,这是因为牛奶中含有的乳糖,在微生物的作用下分解变成了乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为 。完成下列问题:
。完成下列问题:
(1)写出乳酸分子中官能团的名称:____________________。
(2)写出乳酸与足量金属钠反应的化学方程式:___________________。
(3)写出乳酸与碳酸钠溶液反应的化学方程式:________________________。
(4)乳酸在浓硫酸作用下,两分子相互反应生成环状结构的物质,写出此生成物的结构简式:____________。
观察下图中物质分子的比例模型及其变化,回答下列问题。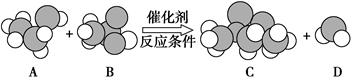
(1)A是乙醇,则B的名称是____________,
C的结构简式是____________________________。
(2)上图所示化学方程式中的“反应条件”是___________________。
(3)反应物中只有乙醇分子中的氧原子是18O,生成物中含这种氧原子的物质是(写物质名称)______________ _。
(4)在B的分子中,最外层电子数为8的原子共有________个。
某有机物的结构简式为HOOC—CH=CHCH2OH。
(1)请你写出该有机物所含官能团的名称:________、________、________。
(2)验证该有机物中含有—COOH官能团常采用的方法是__________________,
产生的现象为____________________。
如图是A分子的球棍模型和B分子的比例模型,回答下列问题:
(1)A和B的关系是_____。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式___________。
(3)写出B分子和金属钠反应的化学方程式_____________________。
(4)B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是____________。
某烃A不能使溴水褪色,0.5 mol A完全燃烧时,得到1.5 mol H2O和67.2 L CO2(标准状况)。
(1)A的结构简式为___________________。
(2)根据下列条件写出有关反应的化学方程式。
①在催化剂FeCl3的作用下,A与Cl2反应生成B:________________。
②在催化剂作用下,A与H2反应生成C:__________。