沼气是一种廉价的能源。农村富有秸秆、杂草等废弃物,它们经微生物发酵之后,便可以产生沼气,可以用来点火做饭。
(1)煤的主要成分是碳,写出煤和沼气中的主要成分燃烧过程的化学方程式:
、 ;并指出哪一种燃料对环境的污染小? 。
(2)我国农村大约有700万个沼气发生池,如果每个沼气池平均每天产生2立方米的沼气(主要是甲烷),1mol甲烷完全燃烧能放出890kJ的热量,计算每天可节约燃烧值为3.36×107J·kg-1的标准煤多少千克?
(2分)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是。
| A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确; |
| B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗; |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液; |
| D.未用标准液润洗碱式滴定管; |
(共6分)0.1mol/L的NaHCO3溶液中
(1)按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(2)c(Na+)+c(H+)=_______________,c(Na+)=_______________。
(4分) 现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)___c(Cl-);
若pH>7,则该溶液中c(NH4+)______c(Cl-)。(填“>”、“<”、“=”).
下图为以惰性电极进行电解: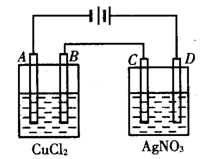
写出A、B、电极上的电极反应式和总反应式:
A:_________________________]B:__________________________,
总反应方程式:________________________;
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)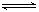 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0[ |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)= υ逆(H2O) d.c(CO2)= c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)= c(CO)·c(H2O),试判断此时的温度为℃。