在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)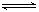 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0[ |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)= υ逆(H2O) d.c(CO2)= c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)= c(CO)·c(H2O),试判断此时的温度为 ℃。
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中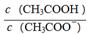 ________(填“增大”“不变”或“减小”),写出表示该混合溶液中所有离子浓度之间的一个等式;
________(填“增大”“不变”或“减小”),写出表示该混合溶液中所有离子浓度之间的一个等式;
(2)常温下向20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为____________,溶液中各种离子(CO32-除外)的物质的量浓度的大小关系为________________;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh= =2×10-4mol·L-1,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=________。
=2×10-4mol·L-1,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=________。
(1)常温下,一种烷烃A和一种单烯烃B组成混和气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
将1L该混和气体充分燃烧,在同温同压下得到2.5L CO2气体。试推断原混和气体中A和B所有可能的组合及其体积比,并将结果填入下表:
| 组合编号 |
A的分子式 |
B的分子式 |
A和B的体积比VA:VB |
(2)烃C与烃A互为同系物,分子中含有11个C原子,8个甲基,则烃C的系统名称为,该烃的二氯代物有种
(共12分)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-的电子式可表示为;1mol C22-中含有的 键数目为。
键数目为。
(2)将乙炔通入[Cu(NH3)2Cl]溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为。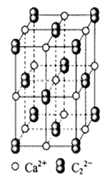
我省的海水资源丰富,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我省可持续发展的重要保证。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出由无水氯化镁制取金属镁的化学反应方程式。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入(选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 |
Cu(OH)2 |
CuS |
Pb(OH)2 |
PbS |
| Ksp |
4.8×10-20 |
6.3×10-36 |
1.2×10-15 |
1.0×10-28 |
(3)火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示: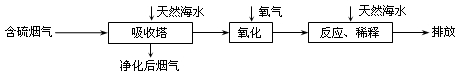
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因(任写一个)。
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。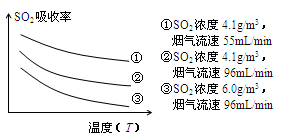
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,氧气氧化的化学原理是(任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是。
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
(1)该反应的平衡常数表达式K=。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。8分钟内,CO的平均反应速率v(CO)=mol/(L·min)。
(3)下列措施中能使平衡时c(CO)/c(CO2)增大的是(填序号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加入一些铁粉 |
(4)铁的重要化合物高铁酸钠是一种新型饮用水消毒剂,具有氧化能力强、安全性好等优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑,则电解时阳极的电极反应式是。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为。