(1)在常温下,发生下列几种反应:
①16H++10Z-+2XO4-===2X2++5Z2+8H2O
②2A2++B2===2A3++2B- ③2B-+Z2===B2+2Z-
根据上述反应,XO4-、Z2、B2、A3+氧化性从强到弱的顺序为:
(2)已知KMnO4与浓盐酸发生如下反应:
2KMnO4 + 16HCl(浓) ="==" 2KCl + 2MnCl2 + 5Cl2↑+8H2O。
在上述反应中,氧化产物和还原产物物质的量之比是 。用单线桥法标出此反应的电子转移方向和数目 。
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成一个配平的化学方程式:
________+________+ H2SO4→ ________+________+________(填化学式)
②反应中1mol氧化剂得到______mol电子。
【化学——选修3:物质结构与性质】
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是(填元素符号),X的价电子排布式为。
(2)B的气态氢化物分子呈形。该分子的中心原子的杂化方式为。
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1)。则1molA的这种单质中π键的数目为。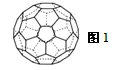
(4)X元素对应的单质在形成晶体时,采用如图2所示的堆积方式。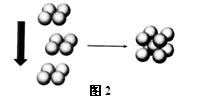
则这种堆积模型的配位数为,如果X的原子半径为a cm,阿伏加德常数的值为NA,则计算此单质的密度表达式为g/cm3(不必化简)。
氨基甲酸铵(H2NCOONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下方法制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0
(1)实验室通常采用图1装置制取氨气,你所选择的试剂是。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是。
液体石蜡鼓泡瓶的作用是。
②从反应后的混合物中分离出产品的实验方法(填操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干b.高压加热烘干c.真空40 ℃以下烘干
③尾气处理装置如图3所示。能否将浓H2SO4改为稀H2SO4(填“能”或“否”),理由是。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000 g。则样品中氨基甲酸铵的质量分数为_______。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。则CO2(g)+3H2(g)=CH3OH(g)+H2O(l)∆H=kJ·mol-1。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K=。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的∆H0(填“>”或“<”)。若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将(填“增大”、“减小”或“不变”)。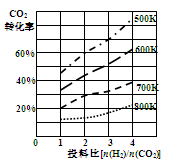
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是。
| A.二氧化碳的浓度 | B.容器中的压强 |
| C.气体的密度 | D.CH3OCH3与H2O的物质的量之比 |
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32-)=。[已知:Ksp(CaCO3)=2.8×10-9]
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 |
Na+ |
K+ |
Ca2+ |
Mg2+ |
Cl- |
SO42- |
HCO3- |
| 含量/mg∙L-1 |
9360 |
83 |
160 |
1100 |
16000 |
1200 |
118 |
(1)海水显弱碱性的原因是(用离子方程式表示):,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。
① 开始时阳极的电极反应式为。
② 电解一段时间,极(填“阴”或“阳”)会产生水垢,其成份为(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:
该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示(填粒子符号),充电时该电极反应式为。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为(空气中氧气的体积分数按20%计)。
硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
(1)要将洗出液中的溶质析出,采用的方法是(填:“蒸发”、“降温”)结晶;蒸发时用到的硅酸盐仪器有、、。
(2)上流程中加入NaOH溶液,反应的离子方程式为。
(3)用上述残渣中的氧化铁焊接铁轨,其铝热反应的化学方程式为(并在方程式中用“单线桥”标出电子转移方向和数目)。