金属镁可用于制造合金、储氢材料、镁电池等。
已知:①C(s)+O2(g) CO(g) ΔH="-110.5" kJ·mol-1②Mg(g)+O2(g)
CO(g) ΔH="-110.5" kJ·mol-1②Mg(g)+O2(g) MgO(s) ΔH="-732.7" kJ·mol-1
MgO(s) ΔH="-732.7" kJ·mol-1
(1)一种制备镁的反应为MgO(s)+C(s) Mg(g)+CO(g),该反应的ΔH= 。
Mg(g)+CO(g),该反应的ΔH= 。
(2)一种用水氯镁石(主要成分为MgCl2·6H2O)制金属镁工艺的关键流程如下:
①为探究MgCl2·6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2·6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。测得E中Mg元素质量分数为60.0%,则E的化学式为 。 “一段脱水”的目的是制备MgCl2·2H2O,温度不高于180 ℃的原因是 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 。 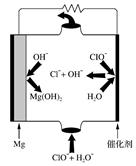
(3)Mg2Ni是一种储氢材料。2.14 g Mg2Ni在一定条件下能吸收0.896 L H2(标准状况下)生成X,X的化学式为 。
(4)“镁-次氯酸盐”燃料电池的装置如右图所示,该电池反应的电极反应式分别为负极 。 正极
下表中实线是元素周期表的部分边界,其中上边界并未用实线画出。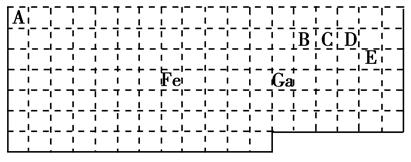
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为________________________________________________。
(2)铁元素位于元素周期表的__________区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________。
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为__________和__________(填化学式)。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__________。
(5)根据VSEPR模型预测ED4-的空间构型为__________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为__________(写3种)。
(1)指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数:______________________。
(2)在[Fe(CN)6]3-中,中心原子的配位数为__________,配体的立体构型是__________。
(3)配合物[Cr(H2O)4Br2]Br·2H2O中,中心原子的化合价为__________,内界的电荷数为__________。
填写下列空白[第(1)~(4)小题用元素符号填写]。
(1)第三周期原子半径最小的元素__________。
(2)第一电离能最大的元素__________。
(3)电负性最大的元素__________。
(4)第四周期中第一电离能最小的元素__________。
(5)含有8个质子,10个中子的原子的化学符号__________。
(6)最外层电子排布为4s24p1的原子的核电荷数为__________。
(7)周期表中最活泼的非金属元素原子的轨道表示式为__________。
(8)某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是__________。
(9)写出铜元素在周期表中的位置__________,它位于__________区。
将与“实验操作”相对应的“实验现象”的字母代号填入“答案”栏中。
| 实验操作 |
答案 |
实验现象 |
| (1)将浓硫酸滴在小木条上 |
A.产生白烟 |
|
| (2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近 |
B.产生蓝色物质 |
|
| (3)在盛有KI淀粉溶液的试管中滴加氯水 |
C.溶液呈红色 |
|
| (4)在盛有FeC13溶液的试管中滴入2滴KSCN溶液 |
D.变黑色 |
下表是中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题。
 |
IA |
0 |
|||||||
| 1 |
① |
II A |
III A |
IV A |
V A |
VI A |
VIIA |
||
| 2 |
② |
③ |
④ |
Ne |
|||||
| 3 |
⑤ |
Al |
S |
⑥ |
(1)⑤表示的元素是;
(2)④的原子结构示意图是;
(3)由①和⑥两种元素组成的化合物的电子式是;
(4)②和③两种元素的气态氢化物更稳定的是(填“②”或“③”)。