下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。单质A能与某气态单质化合生成化合物B。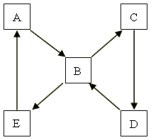
(1)若化合物B是造成酸雨的主要污染物,化合物D是组成单质A元素的最高价氧化物对应水化物,则单质A是 (物质名称),将化合物B通入溴水中观察到的现象是 ,该现象说明化合物B具有
性,写出一个由化合物D生成B的化学方程式 ;
(2)若化合物B可用于生产印刷电路板,化合物B和E的组成元素相同,化合物C是组成单质A元素的最高价氧化物对应水化物,则化合物B能用作净水剂的原因是 (用离子方程式表示,下同),印刷电路板生产中发生的主要反应是 ,检验生产废液中是否含有化合物B的实验操作步骤是 。
已知有机化合物 A、B、C、D、E存在下图所示转化关系,且C能跟NaHCO3发生反应,C和D的相对分子质量相等,E为无支链的化合物。
请回答下列问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为。
(2)B在一定条件下可以发生缩聚反应生成某高分子化合物,此高分子化合物的结构简式为。
(3)C的核磁共振氢谱中有个峰;D也可以由卤代烃F在NaOH溶液中加热来制取,写出此反应的化学方程式。
(4)A的结构简式是。
(5)B有多种同分异构体,请写出一种同时符合下列四个条件的结构简式:。
a.能够发生水解 b.能发生银镜反应
c.能够与FeCl3溶液显紫色 d.苯环上的一氯代物只有一种
有机物A的结构简式为  ,可通过它用不同化学反应分别制得B、C和D 三种物质。
,可通过它用不同化学反应分别制得B、C和D 三种物质。
B、 C、 D、
(1)B中的含氧官能团名称是;A→C的反应类型是。
(2)由A生成B的化学方程式是。
(3)C在一定条件下发生加聚反应的化学方程式是。
(4)C的同分异构体中,有多种反式结构,写出其一种的结构简式。
(5)D在酸性条件下水解的化学方程式是。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式,该反应的氧化产物是。
(2)在溶液Ⅰ中加入KOH固体的目的是(填编号)。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为。
(4)如何判断K2FeO4晶体已经洗涤干净。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列
问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是____________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_____________________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_______________________________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B;C;
沉淀D;溶液E。
(3)写出①、②、③、④四个反应方程式(是离子反应的写出离子方程式)
①;②;
③; ④。