复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH +Na2CO3 = 2CH3COONa+CO2↑+H2O 依照该规律,请判断下列反应不能成立的是___________(填编号)。
+Na2CO3 = 2CH3COONa+CO2↑+H2O 依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2H ClO ClO |
B.CO2+H2O +NaClO = NaHCO3+HClO |
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH NaHCO3+C6H5OH |
D.CO2 +H2O +2C6H5ONa +H2O +2C6H5ONa Na2CO3+2C6H5OH Na2CO3+2C6H5OH |
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa F.CH3COOH+NaCN = CH3COONa+HCN
NaHCO3+C6H5ONa F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值为_______(填数值);pH最大的是 (填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规 律。下列转化都属于复分解反应:
律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得 苛性钠溶液
苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。请根据上述反应,总结出复分解反应发生的另一规律 。
根据这结论,现将Na2S和AgI固体混合搅拌,则反应的离子方程式 。
1,3-丙二醇是生产新型高分子材料PTT的主要原料,目前1,3-丙二醇的生产的路线有:以石油裂解气为原料的两条石化合成路线和一条生物工程法合成路线。
【路线1】丙烯醛水合氢化法: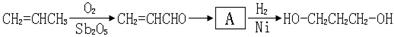
【路线2】环氧乙烷甲酰化法:
【路线3】生物发酵法: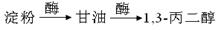
(1)从合成原料来源可持续性的角度看,你认为最具有发展前景的路线是(填1、2或3)。
(2)A的结构简式为。
(3)路线2中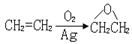 反应类型为。
反应类型为。
(4)环氧乙烷(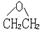 )的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有2个信号峰的有机物的结构简式。
)的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有2个信号峰的有机物的结构简式。
(5)以1,3-丙二醇与对苯二甲酸(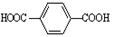 )为原料可以合成聚酯PTT,写出其化学方程式。
)为原料可以合成聚酯PTT,写出其化学方程式。
(6)已知丙二酸二乙酯能发生以下反应:
利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成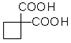 ,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________________,该元素的符号是______;
(2)Z元素在周期表处在______区(填s、p、d),迄今该元素有______种同位素;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为______________________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是____________________________________________________;
(5)X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低顺序分别是(用化学式表示)_________________________________,__________________________________。
A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期且相邻,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是________________,乙物质的电子式是____________。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是__________________(用元素符号填写)。
(3)E的单质遇到A的最高价氧化物对应的水化物的浓溶液会发生____________现象;但加入到C的最高价氧化物对应的水化物的溶液中能反应,反应的离子方程式是:_______。
(4)丙与水反应生成两种碱性物质,试写出该反应的化学方程式____________。
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为。
(3)根据上述反应可推知。
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4 > KBrO3 |
| C.还原性:AsH3>X | D.还原性:X > AsH3 |
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方 向和数目:
向和数目: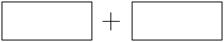
下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。
试回答下列问题: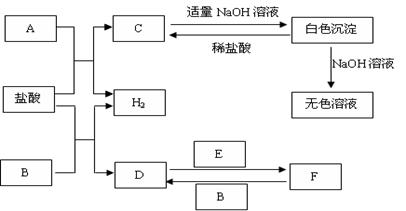
(1)A在周期表中的位置是;
(2)检验F中金属阳离子的常用方法是。
(3)白色沉淀与NaOH溶液反应的离子方程式是。
(4)反应F→D的化学方程式是。