(12分) .
(1)稀释0.1 mol·L-1氨水时,随着水量的增加而减小的是 (填写序号)。
① ②
② ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需的时间B>A
②开始反应时的速率A>B
③参加反应的锌粉物质的量A=B
④反应过程中的平均速率B>A
⑤A溶液里有锌粉剩余
⑥B溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的氨水和盐酸混合后,升高温度(溶质不会分解)溶液的pH随温度变化是图中的_________曲线(填写序号) 。
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1 NaOH溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______________ 。
(5)25℃,将a mol·L-1的氨水与0.0lmol·L-l的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-)。则溶液显____ 性(填“酸’’、“碱”或“中”);用含a的代数式表示NH3·H2O在25℃时的电离平衡常数Kb= 。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+=== 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O ="==" TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________________________________________________________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在____________________范围。
(3)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________________________________(只要求写出一项)。
(4)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| |
TiCl4 |
SiCl4 |
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |
下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题: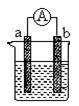
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:
。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置(填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。
现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用碱性溶液为电解液;则氢气应通入极(填a或b,下同),电子从极流出。a极发生电极反应式为:_____________________________。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)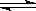 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L.min)。试求:
(1)此时A的浓度为,反应开始前容器中A、B的物质的量为;
(2) B的平均反应速率为;
(3)x=。
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题: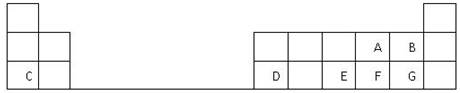
(1)画出A的原子结构示意图__________。
(2)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(3)D在元素周期表中的位置是第3周期第________族。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式________________________。
(6)A、C、D 的离子半径大小关系是___________________ (用离子符号表示)
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
⑴在这些元素中,化学性质最不活泼的原子的原子结构示意图为
⑵在这些元素中,地壳中含量最多的金属元素是
⑶用电子式表示②与④形成化合物的过程 。
⑷这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是,呈两性的氢氧化物是
⑸写出⑤与氢氧化钠溶液反应的化学方程式: 。
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
⑹某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L。则HXR的相对分子量为 ;HXR的化学式为 。