已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: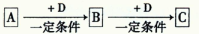
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为——————————————。
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则C中阴阳离子个数比为 ------ 。
(3)若D是常见过渡金属,欲将反应B+D→C设计成原电池,正极材料可以采用------ ,
正极的电极反应式为 —————— 。
(4)若D是一种常见的温室气体:A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为——— 。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 ———— 。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为——— 。
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,任写一个工业上采用氨水吸收B时,水溶液中发生的氧化还原反应的方程式 —-。
(1)铜既能与稀硝酸反应.也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为: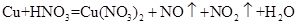 (未配平)
(未配平)
①硝酸在该反应中的作用是__________________,
②19.2g Cu被硝酸完全溶解后,若得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是__________________。
(2)①已知白磷和氯酸溶液可发生如下反应:
P4 + HClO3 + = HCl + H3PO4
配平上述反应方程式。
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O = 20Cu3P + 24 H3PO4 + 60 H2SO4
在该反应中30molCuSO4可氧化P4的物质的量是 。
工业生产硝酸铵的流程图如下:请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_______________(任写一条)。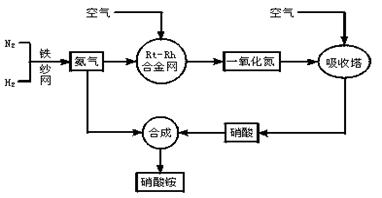
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量___________(填“<” “>” “=”)92.4kJ,理由是 。
(3)写出氨催化氧化的化学方程式:__________________________。
在某无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、Cl-、OH-、HCO3—、NO3—。已知该溶液能跟铝粉反应,且放出的气体只有H2。试回答:
(1)若溶液和铝粉反应后有AlO2-生成,则溶液中一定含有大量的_____________离子,还可能含有大量的________离子。
(2)若溶液和铝粉反应后有Al3+生成则溶液中一定含有大量的________离子,原溶液中一定不含有大量的________离子。
四川盛产五倍子。以五倍子为原料可以制得化合物A。A的结构简式如下图所示:
请回答下列问题:
(1)A中有哪些官能团(写出名称)_______。
(2)有机物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式_________。
(3)1molA最多能消耗 molNaOH;请写出A与过量的NaOH溶液反应的化学方程式________。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看做是B与氢气按物质的量之比1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能使溴水褪色。请写出C与溴水反应的化学方程式________。
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有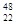 Ti和
Ti和 Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是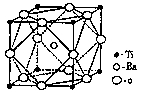
(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
| A.苯与B3N3H6互为等电子体 |
| B.甲醛、苯分子中碳原子均采用sp2杂化 |
| C.苯、二氧化碳是非极性分子,水和甲醛是极性分子 |
| D.水的沸点比甲醛高得多,是因为水分子间能形成氢键 |