同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
| A.它是一种共价化合物 |
| B.在加热时此化合物可以分解为PH3和HI |
| C.这种化合物不能跟碱反应 |
| D.该化合物可以由PH3和HI化合而成 |
恒压密闭容器中充入2molX和5molY,发生反应: ,温度分别为T1和T2时,X的转化率
,温度分别为T1和T2时,X的转化率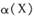 随时间变化的关系如右图所示。则下列结论正确的是
随时间变化的关系如右图所示。则下列结论正确的是
A.达到平衡后,其它条件不变,降低温度,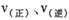 均减小,Y的转化率 均减小,Y的转化率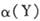 也减小 也减小 |
| B.达到平衡后,其它条件不变,通入稀有气体或者增加M,平衡均向逆反应方向移动 |
| C.当温度为T2时,若开始加人1 mol X,2mol Y ,2 mol Z和1mol M,达到平衡后乙的体积分数约为16.7% |
D.当温度为T1时,若开始加入1molX、2mol Y、2 mol Z和a mol M,达到平衡后若X、Y、Z的物质的量分数与原平衡保持不变,则应满足: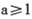 |
下列溶液中微粒浓度关系一定正确的是
利用右图所示的装置,当X、Y选用不同材料,开关K1,与K2处于不同的闭合状态时,可将该装置广泛应用于工业生产。下列说法中正确的是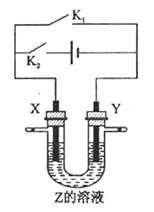
| A.若关闭K2,打开K1,X、Y均为石墨,Z是NaCl,则X附近能得到氢氧化钠 |
| B.若关闭K2,打开K1,X是纯铜,Y是粗铜,Z是CuSO4,该装置可用于铜的楮炼 |
C.若关闭K1,打开K2,X是Cu铜,Y是是H2SO4,则溶液中的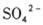 移向Y极 移向Y极 |
| D.若关闭K1,打开K2,X是Cu铜,Y是Fe,Z是含有空气的海水,该装置可用于保护Fe |
下列离子方程式与所述事实相符且正确的是
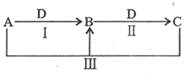
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如右下图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素。下列说法错误的是