25℃时,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH—离子浓度和水电离出的OH—离子浓度之比为( )
| A.1010:1 | B.5×109:1 | C.108:1 | D.1:1 |
下列溶液中有关物质的量浓度关系正确的是
A.0.2 mol/L 的NaHCO3溶液: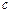 (HCO3_)> (HCO3_)>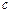 (CO32-)>0.1 mol/L > (CO32-)>0.1 mol/L >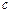 (H2CO3) (H2CO3) |
B.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合: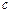 (Na+)> (Na+)>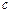 (CH3COO-)> (CH3COO-)>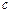 (OH-)> (OH-)>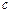 (H+) (H+) |
C.0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合: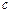 (CH3COO-)+ (CH3COO-)+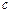 (OH-)- (OH-)-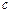 (H+)=0.1 mol/L (H+)=0.1 mol/L |
| D.0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合: |
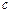 (CO32-)+2
(CO32-)+2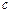 (OH-)=
(OH-)=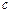 (HCO3_)+3
(HCO3_)+3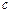 (H2CO3)+2
(H2CO3)+2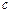 (H+)
(H+)
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应 A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率时间变化的如下图所示。下列说法正确的是
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率时间变化的如下图所示。下列说法正确的是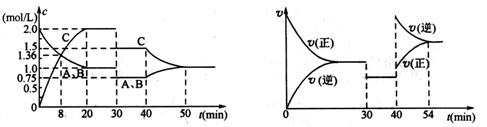
| A.8min前A的平均反应速率为0.08 mol ·L-1·min-1 |
| B.20min~40min间该反应的平衡常数为5 |
| C.30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D.反应方程式中的x=1,且正反应为放热反应 |
某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7。②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中不正确的是
| A.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| B.肯定存在的离子是Na+、K+、SO32-、Br- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断有影响 |
下列离子方程式中正确的是
| A.在酸性硫酸亚铁溶液中加入过氧化氢:Fe2++H2O2+2H+=Fe3++2H2O |
| B.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+ |
| C.在含有Mn2+的溶液中加入HNO3,再加入PbO2,则反应体系显紫红色: 5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2HO |
| D.将数滴0.1 mol/L 盐酸溶液缓缓滴入1 mol/L 50mL Na2CO3溶液中,且不断搅拌: |
2H++CO32-=CO2↑+H2O
肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。电池总反应为:N2H4+O2 N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是
N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是
A.负极的电极反应式是:N2H4+4OH--4e- 4H2O+N2↑ 4H2O+N2↑ |
B.正极的电极反应式是:O2+4H++4e- 2H2O 2H2O |
| C.溶液中阴离子向正极移动 |
| D.溶液中阴离子物质的量浓度基本不变 |