(14分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
(1)锥形瓶中的溶液从_____色变为_____色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应注视________ _;
(3)该小组在步骤①中的错误是_ ___,由此造成的测定结果_____(填偏高、偏低或无影响);
(4)步骤②缺少的操作是_______ ___;
(5)如图,是某次滴定时滴定管中的液面,其读数为 mL
(6)根据下列数据:
| 滴定次数 |
待测液体(mL) |
标准盐酸体积(mL) |
|
| 滴定前读(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
| 第三次 |
25.00 |
0.80 |
23.10 |
请选用合理的数据计算待测烧碱溶液的浓度为_______ mol/L
(7)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2 mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0 g固体试剂,用500 mL容量瓶中配成待测液备用。
(2)将标准盐酸装在已经润洗过的25.00 mL酸式滴定管中,调节液面位置在处,并 记下刻度。
记下刻度。
(3)取20.00 mL待测液,待测定。用甲基橙试剂作指示剂时,滴定到溶液颜色由刚好至色时为止。
(4)滴定达终点后,记下盐酸用去20.00 mL,计算NaOH的质量分数为。
(5)试分析滴定误差可能由下列哪 些实验
些实验 操作引起的。
操作引起的。
| A.转移待测液至容量瓶时,未洗涤烧杯 |
| B.酸式滴定管用蒸馏水洗涤后,直接装盐酸 |
| C.滴定时,反应容器摇动太激烈,有少量待测液溅出 |
| D.滴定到终点时,滴定管尖嘴悬有液滴 |
E.读滴定管开始时仰视,读终点时俯视
进行中和热的测定的装置如图所示。回答下列问题: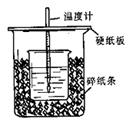
(1)从实验装置中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)利用该装置测得的中和热数值(填“偏大、偏小、无影响”)
(4)某研究小组将装置完善后,把V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示
(实验中始终保持V1+V2=50 mL)。回答下列问题:
①研究小组做该实验时环境温度(填“高于”、“低于”或“等于”)22 ℃。
②由题干及图形可知,V1/V2=:时,酸碱恰好完全中和,此反应所用NaOH 溶液的浓度应为mol/L。
溶液的浓度应为mol/L。
某研究性学习小组利用如图所示装置完成有关实验。
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入。装置Ⅱ从管口进气可作为氨气的收集装置。实验过程中,使用分液漏斗滴加液体的操作是。
(2)该实验剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
(3)实验中若需用所给装置量取NH3的体积,试简述操作方法
所装液体最好是____(填字母编号)
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
本实验应对量气装置多次读数,读数时应注意:①将实验装置恢复到室温,②,③视线与凹液面最低处相平。
【实验二】比较盐酸、碳酸、硅酸的酸性强弱(可以不填满,也可以再加行)
(4)用所给装置设计实验,完成下列表格
装 置序号 置序号 |
仪器中所加物质名称 |
目的或现象 |
用下列两个装置分别进行苯的硝化和苯酚跟甲醛的缩聚实验.
(1)(甲)装置适用于进行 实验.,本实验需要的药品为6
实验.,本实验需要的药品为6 3%
3% 的硝酸、98%的硫酸和苯,向试管中加入药品的顺序为①————————②——————-③————————;
的硝酸、98%的硫酸和苯,向试管中加入药品的顺序为①————————②——————-③————————;
若温度控制在50—600C,其反应的化学方程式为————————;
(2)(乙)装置适用于进行实验.,其化学方程式为—————。
(3)写出苯酚与浓溴水反应的化学方程式
(2分)下列实验操作不正确的是________。