已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)、X的元素名称为: ;X元素的原子基态时电子排布式为: ;Y的元素符号是: ;Y元素原子价层电子的电子排布图是: 。
(2)、若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为:
(填“共价键”或“离子键” )。
(3)、该化合物的孤电子对数为: ;价层电子对数是: ;空间构型为: ;中心原子的轨道杂化类型为: ;该分子为: (填“极性分子”或“非极性分子” )。
(4)、该化合物在常温下为液体,该液体微粒间的作用力为: 。
(5)、该化合物的沸点与SiCl4比较: 的沸点高(填化学式),原因是:
。
使用某些有机物材料给环境造成的“白色污染”后果严重。最近研究的一些分解性塑料,有良好的生物适应性和分解性,能自然腐烂分解。如: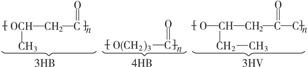
已知3HB的单体叫3-羟基丁酸,则:
(1)4HB的单体名称是_______________,3HV的单体名称是_______________;
(2)两分子4HB的单体脱水时,生成的环酯的结构简式为_______________。
耐纶是一种重要的合成纤维,用它可制取具有光泽、坚牢、耐拉和耐化学腐蚀的人造丝和人造毛。下面是高聚物耐纶分子的一部分。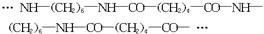
(1)合成耐纶的单体有______________种。
(2)具有碱性的单体的结构简式____________________________。
(3)合成耐纶的反应称为______________反应。
将一段乳胶管放到汽油中浸泡一段时间,可观察到的现象是____________________,其原因是____________________,由此可知,一般的橡胶制品在使用时不宜与____________________直接接触。
下列反应中
①2KClO3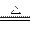 2KCl+3O2↑
2KCl+3O2↑
②C+CO2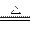 2CO
2CO
③HgS+O2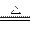 Hg+SO2
Hg+SO2
④2KMnO4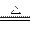 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑤2KNO3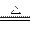 2KNO2+O2↑
2KNO2+O2↑
⑥Cl2+H2O====HClO+HCl
(1)属于一种元素还原两种元素的是__________。
(2)属于同种元素间氧化还原反应的是__________。
下图中各图象表示N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)达到平衡后,只改变一个条件时建立的新平衡的过程。填写下列各空(均填写图序号):
2NH3(g)(正反应为放热反应)达到平衡后,只改变一个条件时建立的新平衡的过程。填写下列各空(均填写图序号):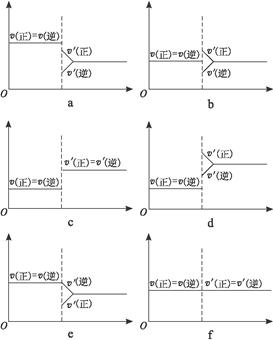
(1)表示减少H2而建立新的平衡的是图_______________;
(2)表示压缩气体体积后建立新的平衡的是图_______________;
(3)表示降低温度而建立新的平衡的是图_______________;
(4)表示体积不变充入N2、H2,同时分离出NH3建立新的平衡的是图_______________;
(5)表示加入催化剂建立新的平衡的是图_______________;
(6)表示充入氩气(体积不变)后,建立新的平衡的是图_______________。