(9分)某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:
《实验原理》:Na2CO3+H2SO4=Na2SO4 + H2O +CO2↑;通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
《实验装置》:如图所示。
《实验步骤》:①如图连接装置(除B、C外)并加入所需药品。②称量并记录B的质量(m1) (称量时注意封闭B的两端) 。③按动鼓气球,持续约1分钟。④连接上B、C。⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。⑥按动鼓气球,持续约1分钟。⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)⑧计算。请回答:
(1)已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用是 ,干燥管C的作用是 ,E装置的作用是 。步骤③中鼓气的目的是 ;步骤⑥中鼓气的目的是 ;本实验能否同时省略③、⑥两个步骤? ,原因是 。
(2)若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL) /mL,若m1为51.20 g ,m2为53.18g ,样品中碳酸钠的质量分数为 。
已知柠檬酸的化学式为C6H8O7.请回答:
(1)柠檬酸中碳、氢、氧三种元素的原子个数比是 ;
(2)柠檬酸中碳、氧元素的质量比为 。
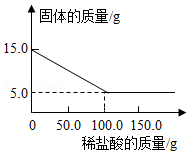
取碳酸钙和硫酸钡的混合物15.0g于烧杯中,将150.0g的稀盐酸平均分成三次加入烧杯中,加入稀盐酸与烧杯中固体的质量关系如图所示,请完成下列问题:
(1)该混合物中硫酸钡的质量为 g;
(2)所加稀盐酸的溶质质量分数是 ;
(3)求恰好完全反应时所得熔液中溶质的质量分数(写出计算过程,精确到0.1%)。
钙是维持人体正常功能所必需的元素,葡萄糖酸钙(C 12H 22O 14Ca)是人们常用的一种补钙剂(已知葡萄糖酸钙的相对分子质量是430)。
(1)葡萄糖酸钙中碳、氧元素质量比为 (填最简比);
(2)要补充0.8g钙元素,则需葡萄糖酸钙的质量为 g。
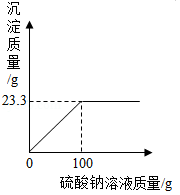
向盛有28g氯化钡和氯化钠固体混合物的烧杯中加入273.3g水,固体完全溶解。再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。(化学方程式为:Na 2SO 4+BaCl 2═2NaCl+BaSO 4↓)
请计算:
(1)固体混合物中氯化钡的质量。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
食醋是厨房中常用的调味品,其中含有醋酸。醋酸的化学式为CH3COOH,请回答:
(1)醋酸属于 化合物(填“有机”或“无机”)。
(2)醋酸的相对分子质量是 ;
(3)醋酸中碳、氢两种元素的质量比是 ;
(4) g醋酸中含6.4g氧元素。