已知:2CO(g)+O2(g)=2CO2(g) ΔH=" --" 566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g) ΔH=" --226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )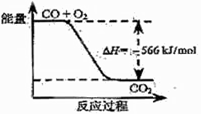
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH< --452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
下列实验结论不正确的是
| 实验操作 |
现象 |
结论 |
|
| A |
食醋浸泡水垢 |
产生无色气体 |
乙酸的酸性比碳酸强 |
| B |
乙醇与橙色酸性重铬酸钾溶液混合 |
橙色溶液变为绿色 |
乙醇具有还原性 |
| C |
碘酒滴到土豆片上 |
土豆片变蓝 |
淀粉遇碘元素变蓝 |
| D |
新制Cu(OH)2与葡萄糖溶液混合加热 |
产生红色沉淀 |
葡萄糖具有还原性 |
3 mol A和2.5 mol B混合于2 L密闭容器中,发生的反应:3A(g)+B(g) xC(g)+2D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论不正确的是
xC(g)+2D(g) 5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论不正确的是
| A.A的平均反应速率为0.15mol/(L·min) |
| B.平衡时,A的转化率为20% |
| C.平衡时,C的浓度为 0.25 mol/L |
| D.容器内的起始压强和平衡压强之比为11:10 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.28 g由C2H4和C3H6 组成的混合物中含有氢原子的数目为4 NA |
| B.1mol甲基含有的电子数为10 NA |
| C.6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |
| D.标准状况下,4.48LCHCl3中分子数为0.2 NA |
下列有关有机物分离提纯或除杂的方法错误的是
| A.溴苯中混有溴,加NaOH溶液洗涤、静置、分液 |
| B.除去乙醇中少量乙酸:加入足量生石灰蒸馏 |
| C.乙酸乙酯中有乙酸杂质,可以加入饱和Na2CO3溶液,充分反应后静置分液 |
| D.乙烯中混有SO2,将其通过盛有酸性KMnO4溶液的洗气瓶,再干燥 |
下列反应中生成物总能量高于反应物总能量的是
| A.氢氧化钠溶液与稀盐酸混合 | B.氢氧化钡晶体与氯化铵晶体混合搅拌 |
| C.乙醇燃烧 | D.铝热反应 |