实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入__________,目的是__________。
(2)反应中加入过量的乙醇,目的是__________________________。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,
边加热蒸馏。这样操作可以提高酯的产率,其原因是________ __________________
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
则试剂a是:____________,分离方法I是____________,分离方法II是____________,
试剂b是______________,分离方法III是______________。
(5)甲、乙两位同学欲将所得含有乙醇、乙酯和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物
乙得到了大量水溶性的物质
丙同学分析了上述实验目标产物后认为上述实验没有成功。
试解答下列问题:
①甲实验失败的原因是:_______________________________________________
②乙实验失败的原因是:_______________________________________________
下图是我校实验室化学试剂浓硫酸标签上的部分内容。
现需要480 mL 1 mol·L-1的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用的仪器有:
①胶头滴管;②玻璃棒;③烧杯;④量筒。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有_________________(写仪器名称)。
(2)经计算,所需浓硫酸的体积约为________mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“>” 、“<” 或“=”)。
(3)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因是________。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).
| 实验操作 |
实验现象 |
| i.打开A中分液漏斗活塞,滴加浓硫酸 |
A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ii.取C中沉淀加入盐酸 |
C中白色沉淀不溶解 |
| iii.打开B中分液漏斗活塞,逐滴滴加H2O2 |
开始时颜色无明显变化,继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是.
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2.
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是.
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是.
③iii中滴入少量H2O2没有明显变化.提出假设:
观点1:H2O2的量少不能氧化Br-
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是.
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是.
亚硝酸钠是一种工业盐,在生产、生活中应用广泛.现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分.
已知:①NO+NO2+2OH-=2NO2-+H2O ②气体液化的温度:NO2:21℃、NO:-152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接):A→C→→→B.
(2)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体中含有NO,依据的现象是___________________.
②装置E的作用是__________________________.
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为.
如果没有装置C,对实验结论造成的影响是_________________________.
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是.
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为 。
(2)工业上常用氯气与熟石灰反应制漂白粉,漂白粉的有效成分为(填化学式)。
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是(填写编号字母);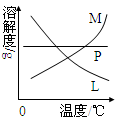
从②的试管中分离出该晶体的方法是(填写实验操作名称)。
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性。为什么?。
(6)若②的试管溶液中不但有KClO3生成还有KClO生成,且二者的物质的量之比为1∶2,则该反应中氧化剂和还原剂的物质的量之比为:。
实验室为完成某一实验,需用240mL1.0mol/L的稀盐酸,现用11.8mol/L的浓盐酸配制,填空并请回答下列问题:
(1)配制完成某一实验所需1.0mol/L的盐酸溶液,应量取浓盐酸体积为mL,所用到的玻璃仪器除量筒、烧杯、玻璃棒外还要用到有、等。
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) →D。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
F.改用某仪器加水,使溶液凹液面恰好与刻度相切
(3)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响):没有进行A操作 ;C操作时不慎有少量液体溅出容量瓶外;定容时俯视_____________。
(4)10.6gNa2CO3与足量所配制的盐酸反应,生成CO2气体在标准状况下的体积是__________升。