甲、乙是同周期的非金属元素,若原子半径甲大于乙,则下列四种叙述中正确的是
| A.最高价氧化物的水化物酸性甲比乙强 |
| B.气态氢化物的稳定性甲比乙弱 |
| C.阴离子的还原性甲比乙弱 |
| D.单质的氧化性甲比乙强 |
向100 mL FeBr2溶液中通入标准状况下的 Cl2 3.36 L ,Cl2全部被还原,测得溶液中c(Br-) =c(Cl-) ,则原 FeBr2溶液的物质的量浓度是()
| A.0.75 mol/L | B.1.5 mol/L | C.2 mol/L | D.3 mol/L |
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
| A.9.02g | B.8.51g | C.8.26g | D.7.04g |
某稀溶液中含有Fe(NO3)3.Cu(NO3)2.HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系入右图所示,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为()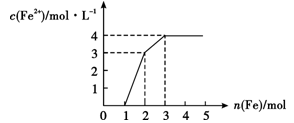
| A.1:1:1 | B.1:3:1 | C.3:3:8 | D.1:1:4 |
向含有 的水溶液中,加入足量的
的水溶液中,加入足量的 固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是()
固体,充分反应后再加入过量的稀盐酸,上述离子数目没有变化的是()
A.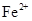 |
B.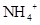 |
C. |
D.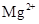 |
下列实验操作与预期目的或所得结论一致的是()
| 选项 |
实验操作 |
实验目的或结论 |
| A |
某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀 |
说明该钠盐是硫酸钠或硫酸氢钠 |
| B |
向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和Na2CO3溶液洗涤、分液 |
得到较纯净的乙酸乙酯 |
| C |
向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 |
说明汽油中含有甲苯等苯的同系物 |
| D |
向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 |
除去FeCl2溶液中的FeBr2 |