工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化。下列说法正确的是
CH3OH(g)+H2O(g)。将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化。下列说法正确的是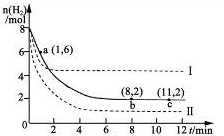
| A.反应开始至a点时v(H2)=1mol·L-1·min-1 |
| B.若曲线I对应的条件改变是升高温度,则该反应△H>0 |
| C.曲线II对应的条件改变是降低压强 |
| D.保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol·L-1<c(CH3OH) <8/3 mol·L-1 |
醋酸在水溶液中存在下列电离平衡:CH3COOH CH3COO-- +H+下列说法不正确的是:
CH3COO-- +H+下列说法不正确的是:
| A.加入醋酸钠,平衡向左移动, | B.加入碳酸钠,平衡向右移动 |
| C.加水稀释,C(H+)减小 | D.加水稀释,溶液中仅有的三种离子浓度都减小。 |
下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是
A.2NO2 N2O4(正反应是放热反应) N2O4(正反应是放热反应) |
B.C(s)+CO2 2CO (正反应是吸热反应) 2CO (正反应是吸热反应) |
C.N2+3H2 2NH3(正反应是放热反应) 2NH3(正反应是放热反应) |
D.H2S H2+S(s)(正反应是吸热反应) H2+S(s)(正反应是吸热反应) |
对于反应A(g)+3(B)g===2C(g),下列各数据表示不同条件下的反应速率,其中反应速率最快的是
A、v(A)=0.01mol·L-1·min-1 B、v(B)=0.02mol·L-1·min-1
C、v(B)=0.60mol·L-1·min-1 D、v(C)=0.60mo l·L-1·min-1
l·L-1·min-1
氨分解反应2NH3 N2+3H2,在容积为2L的密闭容器中进行。已知起始时氨气的物质的量为4mol,5s时为2.4mol,则用氨气表示该反应的速率为
N2+3H2,在容积为2L的密闭容器中进行。已知起始时氨气的物质的量为4mol,5s时为2.4mol,则用氨气表示该反应的速率为
| A.0.32mol·L-1·s-1 | B.0.16mol·L-1·s-1 |
| C.1.6mol·L-1·s-1 | D.0.8mol·L-1·s-1 |
2.24g铁屑与30  mL 2 mol·L-1盐酸充分反应后,溶
mL 2 mol·L-1盐酸充分反应后,溶 液中FeCl2的物质的量为
液中FeCl2的物质的量为
| A.0.02mol | B.0.03 mol | C.0.04mol | D.0.06mol |