能正确表示下列反应的离子方程式为
| A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.Fe3+溶液中滴加过量的氨水: Fe3++3OH-=Fe(OH)3↓ |
| C.Cu2+溶液中滴加过量的氨水: Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ |
| D.将1mol/L NaAlO2溶液和1.5mol/L的HCl溶液等体积均匀混合: |
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
铜锌原电池(如图)工作时,下列叙述正确的是( )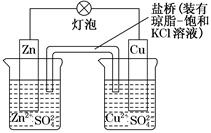
| A.正极反应为:Zn―→Zn2++2e- |
| B.电池反应为:Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+移向ZnSO4溶液 |
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol F-F:153 kJ/mol H-F:565 kJ/mol,下列说法正确的是( )
| A.H2与F2反应的热化学方程式为: H2(g)+F2(g)=2HF(g) ΔH=-541 kJ |
| B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
在一定条件下,将64 g二氧化硫气体氧化成三氧化硫气体时,实验测得放出热量为78.64 kJ,已知二氧化硫在此条件下的转化率为80%。下列热化学方程式书写正确的是( )
A.SO2(g)+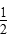 O2(g) O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
B.2SO2(g)+O2(g)  2SO3(l)ΔH=-196.6 kJ·mol-1 2SO3(l)ΔH=-196.6 kJ·mol-1 |
C.SO2(g)+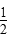 O2(g) O2(g)  SO3(g)ΔH=-78.64 kJ·mol-1 SO3(g)ΔH=-78.64 kJ·mol-1 |
D.2SO2(g)+O2(g)  2SO3(g)ΔH=+196.6 kJ·mol-1 2SO3(g)ΔH=+196.6 kJ·mol-1 |
氯原子对O3分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2ΔH2,大气臭氧层的分解反应是:O3+O=2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )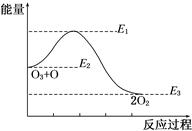
| A.反应O3+O=2O2的ΔH=E1-E3 |
| B.反应O3+O=2O2的ΔH=E2-E3 |
| C.O3+O=2O2是吸热反应 |
| D.ΔH=ΔH1+ΔH2 |
对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释,说法正确的是( )
| A.Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 |
| B.Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化 |
C.MgCO3电离出的CO 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 |
D.MgCO3电离出的CO 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 |