如图为相互串联的甲乙两个电解池,请回答:
(1)若甲池为电解精炼粗铜(含有锌铁镍银金和铂等微量杂质,杂质发生的电极反应不必写出)装置,电解液选用CuSO4溶液,则:
①A电极发生的反应类型为 ; B电极和Fe电极电子的流向由 到 (填B或Fe)。
②B电极的材料是____________,电极反应式为___________ _______。
CuSO4溶液的浓度 (填 “不变”“略有增加”或“略有减少”)
(2)实验开始时,若在乙池两边电极附近同时各滴入几滴酚酞试液,则:
①写出电解NaCl溶液总的化学方程式
。
②在Fe极附近观察到的现象是____ ________。检验碳棒电极反应产物的方法是 _。
(3)若甲槽电解液为CuSO4,实验中发现阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_____ ____L。若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为_______ ___ 。
(16分) 某校化学兴趣小组的同学经查阅资料得知:铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,但奇怪的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组的同学对铝表面的氧化膜进行了探究,其过程如下,请完成下列填空。
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗,片刻后变软,轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。这是因为铝表面氧化膜的熔点________(填“高于”或“低于”)内层铝的熔点,并将其裹住,所以不易发生滴落现象。
(2)取纯净的铝箔,包裹住一小块金属钠后放入水中无现象;将该铝箔用针刺些小孔后再包裹住一小块金属钠后放入水中,迅速就有大量的气泡产生。试解释其中的原因,并写出相关的化学方程式:___________ ___________________。
(3)用砂纸打磨一铝片,使其表面变粗糙,再将其放入CuSO4稀溶液中,2~3 min后有少量红色固体附着在其表面。试写出产生红色固体的离子方程式:。
(4)把两块未用砂纸打磨过的铝片都浸入氢氧化钠溶液中,片刻后其表面产生无色气体。试写出铝的氧化膜与氢氧化钠溶液反应的离子方程式:___________________________。
(5)另取一铝制易拉罐,收集满一罐CO2,加入过量的浓氢氧化钠溶液,立即把口封闭。可以发现易拉罐“咔咔”作响,并变瘪了;过一会后,易拉罐又会作响并鼓起来。试解释为什么,写出有关的离子方程式
运用所学知识,完成下列空白处内容。
(1)取23g钠、24g镁、27g铝分别与足量稀盐酸反应,在相同条件下,产生氢气的体积之比是。
(2)能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是(选填下列字母)。
| A.分别加热这两种固体物质,并将生成的气体通入澄清的石灰水中 |
| B.分别在这两种物质的溶液中,加入CaCl2溶液 |
| C.分别在这两种溶液中,加入同浓度的稀盐酸 |
| D.分别在这两种物质的溶液中,加入少量澄清的石灰水 |
(3)一定量的苏打和小苏打固体分别与足量的稀盐酸反应,若产生的气体体积在标况下均为33.6L,则二者消耗HCl的物质的量之比为,需要二者的固体质量之比为。
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3 kJ。写出该反应的热化学方程式。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为极(填写“正”“负”)该电极上发生的电极反应式是。
(3)右图所示实验装置中,石墨棒上的电极反应式为;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 __________(填物质名称)。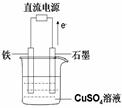
自2010年8月7日,甘肃省舟曲县发生特大泥石流后,各地的救援物资远远不断运往灾区。下图为地方捐助的一种国家准字号补铁补血用药——复方硫酸亚铁叶酸片,其主要成分是绿矾——硫酸亚铁晶体(FeSO4·7H2O)。
Ⅰ、某校课外活动小组为测定该补血剂中铁元素的含量特设计实验步骤如下:
请回答下列问题:
(1)步骤②中加入过量H2O2的目的是。
(2)步骤③中反应的离子方程式为。
(3)步骤④中一系列处理的操作步骤是:过滤、、灼烧、、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为g(用含a的代数式表示)。
Ⅱ、灾难过后,灾区的饮用水变得非常的浑浊,不能饮用。因此对污染的饮用水的处理成了非常重要的事,其中处理的方法有很多:
(1)可以用适量绿矾和氯气一起作用于污染的自来水,而起到较好的净水效果;理由是(用离子方程式表示);;。
(2)在使用过程中发现绿矾和氯气的混合使用对酸性废水中的悬浮物处理效果较差,其原因是。
(10分)已知X、Y、Z是阳离子,K是阴离子,M、N是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为;N的电子式为
(2)试比较M和N的稳定性:M(填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式:;
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
①写出b阶段的离子方程式:
②根据图像判断该盐的化学式为。