常温常压下,将下列各组气体分别充入到容积可变的密闭容器中,充分反应后,恢复到原来状况时体积由大到小的顺序是:①2mol NH3和1mol HCl,②2mol SO2和1mol O2,③2molH2S和1mol SO2,④2mol NO和1mol O2,⑤1mol H2S和1mol Cl2( )
| A.②>④>⑤>①>③ | B.②>⑤>④>①>③ |
| C.④>②=⑤>③>① | D.④=⑤>②>③>① |
下列说法或表示方法正确的是
| A.等质量的硫蒸汽和硫固体分别在氧气中完全燃烧,后者放出的热量少 |
| B.1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 |
| C.HCl与NaOH反应的中和热△=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-2×(-57.3)kJ·mol-1 |
D.一定条件下,0.2molSO2(g)与0.1molO2(g)混合充分反应时放出的热量为18kJ,则有SO2(g)+O2(g) 2SO3(g)△H=-180kJ·mol-1 2SO3(g)△H=-180kJ·mol-1 |
根据下表中烃的分子式排列规律,判断空格中烃的同分异构体的数目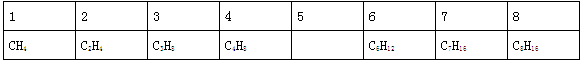
| A.3 | B.4 | C.5 | D.6 |
下列离子方程式书写不正确的是
| A.铜与稀硝酸反应:Cu+2H+=Cu2++H2↑ |
| B.FeCl3溶液中加入铁粉:2Fe3++Fe=3Fe2+ |
| C.常温下氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| D.Ca(NO3)2溶液中滴加少量的K2CO3溶液:Ca2++CO32-=CaCO3↓ |
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
| A.Na+、K+、OH-、Cl- | B.Na+、Cu2+、SO42-、NO3- |
| C.Mg2+、Na+、SO42-、Cl- | D.Ba2+、HCO3-、NO3-、K+ |
下列关于有机物的说法正确的是
| A.甲烷易发生加成反应 |
| B.常温下乙烯易发生取代反应 |
| C.乙酸乙酯是高分子化合物 |
| D.乙醇催化氧化可生成乙醛 |