下列有关溶液的叙述错误的是
| A.常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol·L-1 |
| B.常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12 mol·L-1,则该溶液可能为NaOH溶液 |
| C.相同温度下,1 mol·L-1醋酸溶液与0.5 mol·L-1醋酸溶液中,c(H+)之比小于2∶1 |
| D.导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多 |
下列说法正确的是
| A.氯化钠溶液在电流作用下电离成钠离子和氯离子 |
| B.强电解质溶液不一定比弱电解质的导电性强 |
| C.HR型共价化合物一定是强电解质 |
| D.强、弱电解质的导电性只由它们溶液的浓度决定 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC的工作原理如图所示。下列有关说法正确的是
A.当有0.1 mol电子转移时,a电极产生2.24 L H2
B.b电极上发生的电极反应式为4H2O+4e-===2H2↑+4OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应式为O2+4H++4e-===2H2O
与下列装置相关的说法中不正确的是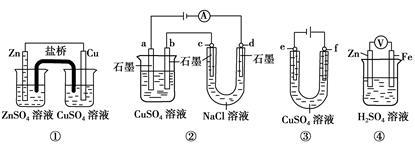
| A.装置①中,盐桥中的K+移向CuSO4溶液 |
| B.装置②中b极析出6.4 g固体时,d极产生2.24 L H2 |
| C.用装置③精炼铜时,f极为粗铜 |
| D.装置④中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
海水总量极大,金、铀等微量元素在海水中的总量自然也大,但从海水中获取这些微量元素的成本很高。其中成本最高的步骤在于
| A.从海水中富集含微量元素的化合物 |
| B.使含微量元素的离子沉淀 |
| C.对含微量元素的混合物进行提纯 |
| D.从化合物中冶炼这些单质 |
化学与能源开发、环境保护、生产生活等密切相关。下列说法正确的是
| A.开发利用可燃冰是缓解能源紧缺的唯一途径 |
| B.将废电池深埋,可以避免其中的重金属污染 |
| C.“地沟油”对人体的危害极大,严禁用做食用油 |
| D.食品保鲜膜、食品袋的主要成分都是聚氯乙烯 |