甲、乙、丙三种固体物质的溶解度曲线如下图所示。
(1)30℃时,丙的溶解度是___________。
(2)20℃时,甲、乙、丙三种物质的溶解度按由大到小的顺序排列的是 。
(3)欲将20℃时丙不饱和溶液变为饱和溶液,可采用的方法是 (写出一种即可)。
(4)5℃时,取甲、乙、丙三种固体物质各20g分别加入盛有100g水的烧杯中,充分搅拌后得到的溶液,能够饱和的是_________________物质的溶液。又将三个烧杯中的混合物温度都升高到30℃,所得溶液溶质质量分数的大小关系是_______________。
(5)现要配制20℃时70g10%的甲溶液。该实验的部分操作如下图所示。
①需要称取甲的质量是________________,称量时图A出现了右盘低的现象,接下来的操作应该是____________________。
| A.左边的平衡螺丝向左调 | B.将游码向左移动 |
| C.右盘中减少砝码 | D.左盘中增加甲 |
②量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数_______________(填“偏大”或“偏小”)。
③图C中用玻璃棒搅拌的作用是________________________。
原子得到或失去电子后形成离子,如图为某种粒子的结构示意图.
(1)当x= 时,该粒子是原子.
(2)当x=9时,该粒子是 (选填“原子”、“阳离子”或“阴离子”).
(3)由x=8与x=13的两种粒子构成的化合物的化学式为 .

2015年8月12日,天津港某化工仓库发生爆炸,其中有一种有毒物质是氰化钠(化学式为NaCN),消防队员用过氧化氢溶液处理该有毒物质的化学方程式是NaCN+H2O2+X═NaHCO3+NH3↑.

(1)其中X的化学式为 ,NaHCO3中C元素的化合价为 价.
(2)过氧化氢常用实验室制取氧气,该反应的化学方程式为 ,属于四种基本反应类型中的 反应,发生装置和收集装置可选用如图中的 (填序号)
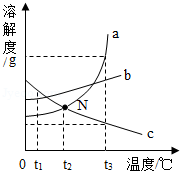
根据图中a、b、c三种固体的溶解度曲线,回答问题。
(1)N点的意义是 。
(2)温度为t 1℃时,a、b、c三种物质的溶解度从大到小的顺序是 。
(3)将t 3℃时a、b、c三种物质的饱和溶液都降温到t 1℃,三种溶液中溶质的质量分数由大到小的顺序为 。
自行车是人们常用的交通工具,请根据如图回答下列问题。
(1)自行车上 是由有机合成材料制成的(填序号)
(2)为防止自行车链条生锈,可采取的措施是 。
(3)自行车的有些部件是由钢铁制成的,请写出用一氧化碳与氧化铁的反应来炼铁的化学方程式 。
(4)实验室为了证明铁的活动性比铜强,可将铁丝浸入到硫酸铜溶液中,其反应的化学方程式为 。
(5)请你从化学的角度写出一种骑自行车出行的好处 。

用适当的数字和符号表示:
(1)3个铁原子 ;
(2)4个甲烷分子 ;
(3)2个氢氧根离子 .