现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液。为了测定碱性调味液中碳酸钠的质量分数,某同学进行了如下实验:取三份碱性调味液各100g,分别缓慢加入到20g、40g和60g某浓度的稀硫酸中,测得三组实验数据见下表(气体的溶解忽略不计):
根据实验及有关数据进行计算:
(1)100g碱性调味液与稀硫酸完全反应生成气体的质量为 g。
(2)碱性调味液中碳酸钠的质量分数为多少?
(3)100g碱性调味液与该稀硫酸反应后溶液pH=7时,消耗稀硫酸的质量为多少克?
某校化学兴趣小组同学用一瓶含有少量氯化钠的硫酸钠固体样品,进行如下图所示的实验。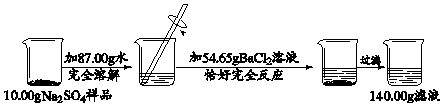
已知:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
请根据以上信息,计算反应后所得溶液中溶质的质量分数。
某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质).取样品10.0g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如下图所示.(有关反应:NaHCO3+HCl=NaCl+H2O+CO2↑)
求:(1)样品中碳酸氢钠的质量分数.
(2)恰好完全反应时,所得溶液中溶质的质量分数.
将铜和氧化铜固体混合物粉末11.2g放入烧杯中,当加入稀硫酸100 g时,氧化铜与硫酸恰好完全反应.过滤后所得溶液的质量为108g,(不考虑过滤过程中溶液的质量损失).
(1)混合物中铜元素的质量分数为 (计算结果保留到0.1%)
(2)求稀硫酸中H2SO4的质量分数.(写出计算过程)
工业上用煅烧石灰石(主要成分为CaCO3)制取生石灰,其生产流程图如下:
(1)某工厂用12t含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是 t.
(2)上述石灰石理论上可以制得生石灰多少t?(写出计算过程)
请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:
(1)实验所用稀盐酸的溶质的质量分数为 .
(2)计算原混合物样品中CaCl2的质量(写出计算过程).