Ⅰ用元素符号或化学式回答原子序数11~18的元素的有关问题:
(1)除稀有气体外,原子半径最大的元素是________________;
(2)最高价氧化物对应水化物呈两性的元素是________________;
(3)最高正价氧化物对应水化物酸性最强的酸是________________;
(4)能形成气态氢化物且氢化物最稳定的元素是________________
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得
2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得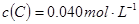 ,放出热量Q1 kJ。
,放出热量Q1 kJ。
(1)能说明上述反应已经达到化学平衡状态的是______________(填字母编号)
a.v(C)=2v(B) b.单位时间内生成2mol A的同时消耗1molB
c.容器内压强保持不变 d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050mol C,500℃时充分反应达平衡后,吸收热量Q2 kJ,则Q1与Q2之间的关系式可表示为___________________________(用含Q1、Q2的代数式表示)。
(3)500℃时,上述反应的化学平衡常数K=____________________。
(4)已知K(300℃)>K(350℃),该反应是__________(填“放”或“吸”)热反应;若反应温度升高,A的转化率___________________(填“增大”、“减小”或“不变”)。
(5)某温度下,A的平衡转化率 与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”。 )
与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”。 )
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。已知B元素形成的化合物种类最多,D元素原子最外层电子数是次外层电子数的3倍,元素E的原子半径在同周期中最大,F元素原子最外层电子数等于其电子层数。
(1)C元素在元素周期表中的位置是_____________________,B的单质与C的最高价氧化物对应水化物的浓溶液发生反应的化学方程式是_____________________________________
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是_______________
(3)写出E2D2与A2D反应的离子方程式
_______________________________________________________________________。
(4)实验室配制100mL0.2mol·L—1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、小烧杯外还有_________________________;如果定容时仰视刻度线,则所配制溶液浓度_________0.2mol·L—1(埴“>”、“<”或“=”)。将F的单质溶于上述配制的溶液中所发生反应的离子方程式是_________________________
人们已经研制出以丙烷为燃料的新型燃料电池,电解质为熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O。
(1)已知:2C3H8(g)+7O2(g)=6CO(g)+8H2O(l)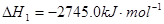
C(s)+O2(g)=CO2(g)
2C(s)+O2(g)=2CO(g)
则反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(1)的△H___________________。.
(2)该电池的正极通入O2和CO2,负极通入丙烷,则正极的电极反应式为_________________,电池工作时CO32—移向_____________极。
(3)用该电池电解1L 1 mol·L—1的AgNO3溶液,此电解池反应的化学方程式为______________________;当该电池消耗0.005molC3H8时,所得溶液的pH为__________(溶液体积变化忽略不计)
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n |
Ksp |
开始沉淀pH |
沉淀完全pH |
| Al(OH)3 |
1.9×10-23 |
3.4 |
4.2 |
| Fe(OH)3 |
3.8×10-38 |
2.5 |
2.9 |
| Ni(OH)2 |
1.6×10-14 |
7.6 |
9.8 |
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:
。
(3) 检验电解滤液时阳极产生的气体的方法:
。
(4) 写出“氧化”反应的离子方程式:
。
(5) 如何检验Ni(OH)3已洗涤干净?
。
现有某金属硝酸盐的化学式为M(NO3)2,为了探究其热分解产物,某化学小组开展探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同。如,2KNO3 2KNO2+O2↑,
2KNO2+O2↑,
2Cu (NO3)2 2CuO+4NO2↑+O2↑, 4AgNO3
2CuO+4NO2↑+O2↑, 4AgNO3 4Ag+4NO2↑+2O2↑
4Ag+4NO2↑+2O2↑
【提出猜想】猜想1 M(NO3)2 M(NO2)2+O2↑
M(NO2)2+O2↑
猜想2 2 M(NO3)2 2MO+4NO2↑+O2↑
2MO+4NO2↑+O2↑
猜想3。
【设计实验】为了探究上述猜想,设计如下实验装置:
【实验步骤】①连接仪器;②检查装置气密性;③取一定量样品装入大试管中,并重新连接好仪器;④加热;⑤……
⑴写出猜想3的化学方程式:;
⑵测定气体体积应选择(填A或B);不选另一个装置的理由是
;
⑶实验收集到一定量气体是,量筒读数前应注意;
为了检验收集气体的成分,其操作方法是
;
⑷在实验后量筒里的水中加入适量碳酸氢钠粉末,溶液中产生大量气体,说明正确(填“猜想1”、“猜想2”或“猜想3”);
⑸该小组测得两组数据:①实验前样品质量为Wg,收集到气体体积为V L;②实验前
样品质量为Wg,完全分解后测得固体产物质量为m g;
请你选择其中一组数据,计算元素M的相对原子质量为。