在水溶液中发生下列反应:YO3n-+3S2-+6H+=Y-+3S↓+3H2O,下列说法不正确的是在
| A.YO3n-中Y的化合价是+5 | B.n=1() |
| C.Y元素原子的最外层电子数为5 | D.还原性:S2->Y- |
下列说法中正确的是 ( )
| A.某反应在低温条件下能自发进行,那么该反应在高温条件下也一定能自发进行 |
| B.某反应在高温条件下不能自发进行,那么该反应在低温条件下也一定不能自发进行 |
| C.反应方向是由焓变和熵变共同决定的,与反应温度无关 |
| D.温度有可能对反应的方向起决定性作用 |
在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)="12" n(B)时,可判断x=4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
已知可逆反应X(g)+Y(g)  Z(g) (未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g) (未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是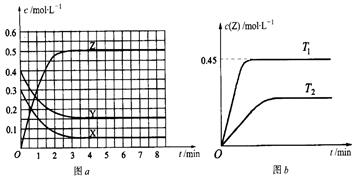
| A.图a中,各物质的反应速率大小关系为:v(X)=" v(Y)=" 2v(Z) |
| B.T0时,该反应的平衡常数为0.03 |
| C.图a中反应达到平衡时,X、Y的转化率相同 |
| D.T1时的平衡常数大于T2时的平衡常数,但小于33.3 |
常温下甲、乙两醋酸溶液,测得甲的pH= a,乙的pH= a+1。下列推断中正确的是
| A.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍 |
| B.物质的量浓度c(甲)=10c(乙) |
| C.中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲) |
| D.甲中的c(OH-)为乙中的c(OH-)的10倍 |
用惰性电极电解一定浓度的硫酸铜溶液,通电一定时间后,向所得溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中共转移电子数为
| A.0.4mol | B.0.5mol | C.0.6mol | D.0.8mol |