(8分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 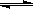 2SO3(g) △H=-190 kJ·mo1-1
2SO3(g) △H=-190 kJ·mo1-1
(1)在一固定容器中充入2mol SO2和1molO2,在一定的条件下达到平衡,反应放出的热量__________(填大于、小于或等于) 190 kJ
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=______mol·L-1·min-1
(3)下列条件的改变对其反应速率几乎无影响的是 (选填序号)
①升高温度 ②保持体积不变,只增加氧气的质量 ③保持体积不变,充入Ne使体系压强增大 ④保持压强不变,充入Ne使容器的体积增大
(4)下列描述中能说明上述(1)反应已达平衡的是 (选填序号)
①v(O2)正=2v(SO3)逆 ②SO2、O2 、SO3的浓度之比为2:1:2
③单位时间内生成2n molSO2的同时生成2n mol SO3
④容器中气体的平均分子量不随时间而变化
⑤容器中气体的密度不随时间而变化 ⑥容器中气体压强不随时间而变化
有机物A1和A2互为同分异构体,分别和浓H2SO4在一定温度下共热都生成烃B和水,B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,1 mol B可以和4 mol H2发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系如下: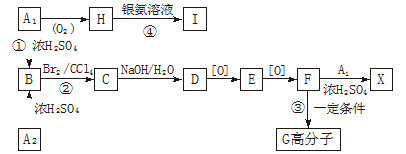
(1)反应①属于_______________反应,反应②属于_______________反应。
(2)写出A2与X两种物质的结构简式:
A2_____________________,X__________________________。
(3)写出反应③和④的化学方程式:
③___________________________________,
④___________________________________。
(4)化合物E有多种同分异构体,其中属于酯类且具有两个对位侧链的同分异构体有四种,除下列两种外,另外两种的结构简式是:
_________________________________,_________________________________。
下列所述各微粒都是由短周期元素组成的。
(1)由两种短周期元素组成的A、B两种分子,分子中电子总数均为18且相对分子质量相同。若A、B能发生氧化还原反应,生成黄色固体单质。请写出该反应的化学方程式;反应中若生成1mol该单质,则转移电子的个数为。
(2)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。W与Z同周期;W和Y不属于同一主族;Y元素原子最外层电子数占核外电子总数的3/4;W元素原子最外层电子数比Z元素的最外层电子数多5个电子。请写出由Z、W两种元素组成的化合物的电子式。由X、Y按原子个数比为1:1组成的化合物的电子式。
(3)由X和Y两元素可形成C+、D-、E三种微粒(分子或离子),它们都分别含有10个电子,已知它们有转化关系D-+ C+=2E;请写出与微粒D-原子种类和个数完全相同但不带电的另一种微粒的电子式。
有一包固体混合物,可能含有的阴、阳离子分别是:
| 阳离子 |
K+、Ba2+、Ag+ |
| 阴离子 |
SO42-、CO32-、AlO2-、SO32- |
为了鉴定其中的离子,现进行如下实验。根据实验现象,填写下表:
(1)取该粉末,加水后得到无色溶液,用pH试纸测得溶液的pH=12。
| 排除的离子 |
排除的依据 |
(2)向溶液中滴加盐酸,先有沉淀生成,继续滴加沉淀消失,同时有无色无味气体逸出。
| 肯定存在的阴离子 |
判断依据 |
| 排除的离子 |
排除的依据 |
(3)尚待检验的离子及其检验方法
| 尚待检验的离子 |
检验的方法 |
(1)室温下,在pH=12的某种溶液中,由水电离的c(OH-)为____________。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是____________。
①0.2 mol·L-1的CuSO4溶液
②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl
④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是_________________(填序号)。
①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA-, HA- H++A2-。
H++A2-。
①则Na2A溶液显__________________(填“酸性”“中性”或“碱性”),理由是_______________________________(用离子方程式表示)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是:(填序号)。
| A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
(10分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g) + B(g)  xC (g) + D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x = 
(2)从反应开始到40s达平衡状态,A的平均反应速率为
(3)平衡时容器中B的体积分数为
(4)该温度下此反应的平衡常数表达式为数值是
(5)下列各项能表示该反应达到平衡状态是
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
(6)在相同温度下,若起始时c(A)="5" mol·L-1,c(B)=6mol·L-1,反应进行一段时间后,测得A的浓度为3mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”)。