下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1。向1L 0.5mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 |
| B.△H1<△H3<△H2 |
| C.△H1<△H2<△H3 |
| D.△H1>△H3>△H2 |
关于强、弱电解质的叙述正确的是
| A.强电解质都是离子化合物,弱电解质都是共价化合物 |
| B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 |
| C.强电解质在水溶液中的电离是不可逆的 |
| D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是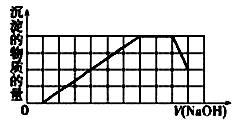
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1 |
| C.原溶液中一定含有SO42- 和Na+ |
| D.反应最后形成的溶液中溶质只有Na2SO4 |
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
| A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| B.加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
| C.c(Fe3+)=0.1mol·L-1的溶液:H+、Al3+、I-、SCN- |
| D.常温下pH=12的溶液:Na+、K+、SiO32-、NO3- |
以下物质间的转化通过一步反应不能实现的是
①.HCl→Cl2→HClO→NaClO
②.Na→Na2O2→Na2CO3→NaHCO3
③.Al→NaAlO2 →Al(OH)3→Al2O3
④.Si→SiO2→H2SiO3→Na2SiO3
⑤.S→SO3→H2SO4→Na2SO4
⑥.Cu→CuCl2→Cu(OH)2
| A.②③ | B.④⑤ | C.③④⑤⑥ | D.①④⑤ |