为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是
| A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| B.将大小、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
下列有关化学用语使用正确的是:
A.硫离子的结构示意图: |
B.NH4Cl的电子式: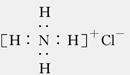 |
| C.原子核内有10个中子的氧原子:18 8O | D.Na2O2的电子式为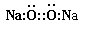 |
下列与化学反应能量变化相关的叙述正确的是:
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下, H2(g)+ Cl2(g)==="2HCl(g)" 在光照和点燃条件下反应的ΔH不同 |
下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+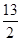 O2(g)===4CO2(g)+5H2O(l)ΔH=-2878 kJ/mol
O2(g)===4CO2(g)+5H2O(l)ΔH=-2878 kJ/mol
②C4H10(g)+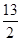 O2(g)===4CO2(g)+5H2O(g)ΔH=-2658 kJ/mol
O2(g)===4CO2(g)+5H2O(g)ΔH=-2658 kJ/mol
③C4H10(g)+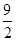 O2(g)===4CO(g)+5H2O(l)ΔH=-1746 kJ/mol
O2(g)===4CO(g)+5H2O(l)ΔH=-1746 kJ/mol
④C4H10(g)+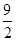 O2(g)===4CO(g)+5H2O(g)ΔH=-1526 kJ/mol
O2(g)===4CO(g)+5H2O(g)ΔH=-1526 kJ/mol
由此判断,正丁烷的燃烧热是:
| A.-2878 kJ/mol | B.-2658 kJ/mol |
| C.-1746 kJ/mol | D.-1526 kJ/mol |
相同状况下:H2(g)+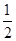 O2(g)===H2O(g) ΔH=-Q1kJ/mol;
O2(g)===H2O(g) ΔH=-Q1kJ/mol;
2H2(g) +O2(g)===2H2O(l) ΔH=-Q2kJ/mol
则Q1和Q2的关系为:
| A.Q1>Q2 | B.Q1=Q2 | C.2Q1<Q2 | D.Q1=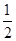 Q2 Q2 |
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH—4e-=4H2O O2+2H2O+4e-=4OH-据此作出判断,下列说法中错误的是:
| A.供电时的总反应是:2H2+O2=2H2O | B.产物为无污染的水,属于环境友好电池 |
| C.燃料电池的能量转化率可达100% | D.H2在负极发生氧化反应 |