用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如下图所示,分析判断:________段化学反应速率最快。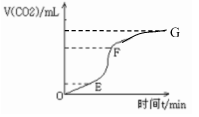
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.氯化钠固体 |
| C.氯化钠溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答两种)
某二元弱酸H2A溶液,按下式发生一级和二级电离:
H2A H++HA-
H++HA-
HA- H++A2-
H++A2-
已知相同浓度时H2A要比HA-的电离能力强,即:K1>>K2。设有下列四种溶液:
A.0.01mol.L-1的H2A溶液
B.0.01mol.L-1的NaHA溶液
C.0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
D.0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
c(H+)最大的是___________,最小的是 。
c(H2A)最大的是_____________,最小的是__________。
c(A2-)最大的是______________,最小的是___________。
把AlCl3(aq)蒸干灼热,最后得到的固体产物是什么?(用化学方程式表示,并配以必要的文字说明) 。
氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)请简要说明这种检验方法的依据:
。并写出有关反应的化学方程式为。
肼(N2H4)是火箭推进剂的成分之一,它与另一成分NO2反应生成N2和H2O,反应的化学方程式为,其中氧化剂是,该反应除产生大量的热量外,还有一突出的优点是.
锌与硝酸反应,若有1mol硝酸参加法院,则有0.8mol的电子发生转移,此时硝酸的还原产物中N元素的化合价 。